具体信息
每年有30,000名英国人和365,000名美国人死于肥胖和缺乏运动。[1][2][3][4] III 级肥胖(体重指数为 40 或以上)的发病率正在快速增加,全球接受减重手术的患者也越来越多。一些大规模的前瞻性试验已经表明:减重手术可以改善所有年龄段 III 级肥胖患者的生活质量,并降低死亡风险。[5][6][7][8][9][10][11] 研究表明,III 级肥胖的儿童和青少年患者可以从减重手术中获益。[12] II 级(体重指数为 35-39.9)至 III 级肥胖的患者应接受全面评估,并在减重手术后的近期和远期接受护理。[13]
目前还在研究将减重手术(也称为代谢手术)作为 2 型糖尿病一种可能的主要治疗方法。随机对照临床试验以及系统评价和 meta 分析的结果显示,在肥胖的 2 型糖尿病患者中,减重手术对血糖的控制优于单用传统药物治疗。[14][15][16][17][18] 此外,美国糖尿病协会 (American Diabetes Association)、英国国家卫生与临床优化研究所以及国际糖尿病基金会的指南建议,对于仅采用最佳药物治疗不足以控制血糖的肥胖合并 2 型糖尿病患者,可进行减重手术。[19][20][21][22]
一项小型随机试验表明,对于有高血压的肥胖患者,与给予单纯的药物治疗相比,实施减重手术减少了控制血压所需的降压药数量 (≥30%)。[23]
减重手术治疗肥胖的作用机制尚不完全明确,但目前认为可能与胃容量限制、吸收不良和激素改变有关。[24][25]
患者在行减重手术后,可能到门诊、急诊科或行手术所在医院之外的其他医院就诊。因此,需要了解常见的并发症。[26] 可能难以检查中心性肥胖患者的腹部,并且中心性肥胖可掩盖脓毒症的典型体征。因此密切注意生命体征、实验室检查结果以及一切偏离预期的术后病程十分重要。
为了帮助患者维持减肥手术后的体重减轻,可能需要常规自我监测和频繁的术后随访。[27]
难以预测减肥手术后的体重减轻,因为可能受到易感性遗传因素、[29][30] 术前体重和是否依从术后饮食和活动水平计划的影响。术后体重下降的程度主要通过多余体重丢失的百分比来检测,而多余体重等于原始体重减去理想体重。一篇有关减肥外科的系统性综述报道称,从长期(2年或以上)效果来看,可调节胃束带术可以减少49%的多余体重,而胃旁路术和的胆胰转流伴十二指肠转位术,可分别减少63%和73%的多余体重。[18] 据报道,袖状胃切除术后 5 年、6 年、7 年、8 年和 11 年的平均超重体重减重百分比分别为 58.4%、59.5%、56.6%、56.4% 和 62.5%。[31]
除了体重减轻外,减肥手术还对 2 型糖尿病和其他肥胖相关疾病的消退有显著影响,超过药物措施所能达到的效果。[14][15][16][17][18]
Roux-en-Y胃旁路术是有史以来世界范围内最常见的减肥术式,2003年在美国施行的减肥手术中就有80%是Roux-en-Y胃旁路术。[32][33] 但在二十世纪初,可调节胃束带术变得越来越普遍,而近年来,袖状胃切除术备受推崇。
旁路术可以在开放或者腔镜手术下完成。 腔镜手术只需要建立5到7个戳口,戳口长度从5mm到15mm不等,而开放手术一般需要行腹部正中切口。 腔镜手术的术后疼痛轻、恢复快、切口相关并发症少。[34]
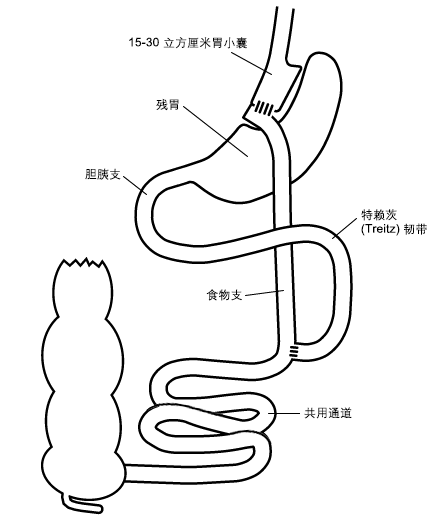
用外科切割吻合器把胃分成两个部分。 上部为基于胃小弯的胃小囊(位于右侧),容量15mL至30mL。 旷置胃底部。
用切割吻合器在屈氏韧带下 20 cm 到 100 cm 的位置横断空肠。将近端空肠于远端空肠(或称 Roux 支)下 75 cm-150 cm 处行端侧吻合。Roux 支与胃囊吻合,从而形成 Y 形的肠道解剖结构。
远端胃完全旷置,无食物通过。 其分泌的胃液和胆汁、胰液一起沿着胆胰支(长20cm到100cm)流下。
食糜经由食管进入胃小囊,然后通过近端吻合口进入Roux支或消化支(长75cm到150cm)。 分泌的消化液通过远端吻合口与食糜一起进入总通道(长150cm到400cm)。
术后,普通胃镜和肠镜无法到达残余胃和胆胰支,无法施行经内镜逆行胰胆管造影术。
 [Figure caption and citation for the preceding image starts]: Roux-en-Y 胃旁路术示意图版权所有©2008 Daniel M. Herron, MD; 使用许可 [Citation ends].
[Figure caption and citation for the preceding image starts]: Roux-en-Y 胃旁路术示意图版权所有©2008 Daniel M. Herron, MD; 使用许可 [Citation ends].
术后 30 天内发生的并发症称为早期并发症。一项关于随机试验的大型荟萃分析报道称:胃旁路术的死亡率小于 0.1%。[35] 医生们也一直试图通过分析术前影响因素来为死亡风险分级。[36] 与开放式 Roux-en-Y 胃旁路术相比,行腹腔镜 Roux-en-Y 胃旁路手术 (RGB) 后切口感染、腹壁疝及肺部受累发生率更低。[34] 胃旁路术的早期并发症包括肠瘘或脓毒症、深静脉血栓形成 (DVT) 和肺栓塞 (PE)、消化道 (GI) 出血、间隔室综合征或早期肠梗阻。为了减少诸如此类的并发症,相关的最佳实践指南详细推荐了实施减重手术所需的外科技术、设备和医疗资源。[37][38][39]
肠瘘或败血症
美国代谢和减肥外科协会(American Society for Metabolic and Bariatric Surgery ,ASMBS)出版了预防和诊断胃旁路术后肠瘘的相关指南。[40][41]
肠瘘有可能发生于近端吻合口(胃-空肠吻合口)、远端吻合口(空肠-空肠吻合口)、胃小囊闭合端、残余胃闭合端,或胃、小肠、大肠的其他部位。 上消化道瘘的发病率大约在2%到3%之间,腹腔镜下手术或开放手术的发病率相仿。[42][43]
症状包括腹痛、肩背痛、焦虑或濒死感。
体征包括心动过速>110-120 次/分、发热(>38.5°C[101.3°F])、呼吸窘迫(呼吸短促或呼吸急促>20 次/分),或术后恢复与预期过程存在差异。对于有中心性肥胖的患者,腹部压痛、反跳痛或肌肉紧张等腹部脓毒症的典型体征可能不可靠或不存在。
虽然上消化道造影或计算机体层成像 (CT) 扫描的阳性结果有助于肠瘘的诊断,但是影像检查一般呈假阴性。依据阴性结果,不能排除肠瘘这一鉴别诊断。
治疗包括早期静脉输注广谱抗菌素、补液。 诊断不明确时,建议尽快行手术探查。 探查可在开放或腔镜条件下进行。
手术操作包括腹腔冲洗、瘘口缝合及大网膜包裹、肠瘘处放置腹腔引流、胃小囊或空肠内放置胃管。
深静脉血栓(DVT)和肺栓塞(PE)
DVT/PE 主要见于减肥手术出院后。[44]
深静脉血栓及继发的肺栓塞可能是减肥手术后最常见的死亡原因。[45] 大约1%到2%的患者会发展为肺栓塞,死亡率在0.2%到0.6%之间。[46][47] DVT/PE 的诱发因素包括肥胖、全身麻醉和活动能力受损,这见于所有接受减肥手术的患者。其他危险因素包括年龄 50 岁以下、既往深静脉血栓/肺栓塞病史、吸烟史、修改手术、开放手术史、吻合口漏、充血性心力衰竭、截瘫和静息时呼吸困难。[48][44]
多个健康组织发布了减肥手术中 DVT/PE 的预防治疗建议。 美国心内科医师协会( American College of Chest Physicians)的循证指南推荐,行普外科大手术的患者可使用低分子肝素、小剂量磺达肝癸钠、小剂量普通肝素预防血栓形成。[49] 英国国家医疗护理协会( National Institute for Health and Care Excellence)已公布了旨在降低住院患者深静脉血栓/肺栓塞危险性的治疗指南。[50] 美国代谢和减重外科学会 (American Society for Metabolic and Bariatric Surgery) 发布了一份立场声明,内容是针对降低减重手术患者发生 DVT/PE 风险的预防措施。[51]
预防措施包括尽早下床活动,使用序贯加压设备以及普通肝素或低分子量肝素。[52] 对高危患者,推荐使用临时下腔静脉滤器,术后持续内科药物预防至少14天。[53]
深静脉血栓形成/肺栓塞具有诊断意义的特征性表现(呼吸短促、胸痛、心动过速)不具有特异性,也可能提示肠瘘的诊断。下肢深静脉血栓形成通常需要经多普勒超声检查进行诊断。CT 血管造影是诊断肺栓塞的有效方法。在这种情况下,关于使用 CT 血管造影诊断 DVT 缺乏充分的描述。
胃肠道出血
腹腔筋膜室综合征,其特点主要包括:
腹腔内水肿,腹腔间室内压大于25mmHg,静脉回流障碍,从而导致终末器官衰竭。 这可能导致腹腔感染、出血或肠梗阻。 首要临床表现为少尿和肾衰竭。
膈肌活动受阻可能会导致呼吸衰竭。
通过用带有三通活塞的Foley导尿管检测膀胱压力,可以诊断腹腔筋膜室综合征。 膀胱空虚时,注入50cc生理盐水,夹闭导尿管。 检测导管内压力。 若压力大于25mmHg,需要进行外科开腹减压。
早期肠梗阻
伤口感染
据报道,胃旁路手术中伤口感染的发生率高达20%。[56]
一项研究发现,腹腔镜 Roux-en Y 胃旁路术的伤口感染率 (1%) 低于开放性 Roux-en Y 胃旁路术的 (10%)。[34]
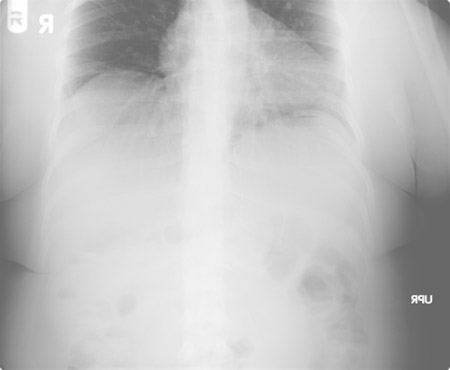 [Figure caption and citation for the preceding image starts]: 远端吻合口梗阻的腹部X线平片表现: 旁路胃(残余胃)未见明显气泡Daniel M. Herron, MD 提供 [Citation ends].
[Figure caption and citation for the preceding image starts]: 远端吻合口梗阻的腹部X线平片表现: 旁路胃(残余胃)未见明显气泡Daniel M. Herron, MD 提供 [Citation ends]. [Figure caption and citation for the preceding image starts]: 同一位患者的腹部CT片可见残余胃严重膨胀。 在CT引导下,很容易经皮穿刺到达膨胀的残余胃。Daniel M. Herron, MD 提供 [Citation ends].
[Figure caption and citation for the preceding image starts]: 同一位患者的腹部CT片可见残余胃严重膨胀。 在CT引导下,很容易经皮穿刺到达膨胀的残余胃。Daniel M. Herron, MD 提供 [Citation ends].
晚期并发症指术后30天以上发生的并发症。 它们包括:
消化道狭窄引起的呕吐
近端吻合口狭窄是 Roux-en Y 胃旁路术最常见的并发症。报道称其发病率在 0.6%-27% 之间。[57]
症状一般在术后 3-6 周出现,包括进行性固体食物不耐受以及最终只能摄入流体饮食。可能伴有吞咽困难、恶心、呕吐。[58]
出现以上症状的患者,结合减肥手术史可以初步诊断消化道狭窄,胃镜检查可确诊。 胃镜下同步行球囊扩张至10mm到15mm可以立即缓解症状。 之后患者可以立即恢复半流体饮食。 大部分的狭窄需要行2次以上的球囊扩张。[59]
一般不需要行上消化道 (GI) 吞钡造影,因为这可能会延误内镜下治疗的时机,并且有可能导致造影剂误吸。
用直线吻合器代替圆形吻合器建立近端吻合口可能会降低狭窄发生率。[60]
腹内疝
曾经接受过胃旁路手术的患者出现腹痛应当想到内疝的可能性,特别是发生在术后 3 个月或更长的时间时。 其发病率大约为3%。[61]
典型症状为上腹痛,可放射至背部。 症状可急可缓,还可能类似于胆绞痛。
患者的主诉可能是类似的多次腹痛发作。患者可能已接受过超声、上消化道造影或计算机体层成像检查,即使存在腹内疝,上述检查也可能呈阴性。[62]
在曾经接受过胃旁路手术的患者中,内疝可能发生的三个部位是:
Peterson疝孔,位于Roux支(消化支)后。
远端肠系膜孔,位于远端吻合口的两片肠系膜之间
结肠系膜孔, 见于行结肠后胃空肠吻合的减肥手术患者(该疝孔是位于结肠系膜的医源性裂孔)。 肠管可能会穿过这些疝孔形成疝。
肠管嵌顿,血供不足会引起腹痛。 持续性的局部缺血最终会导致肠管坏死。
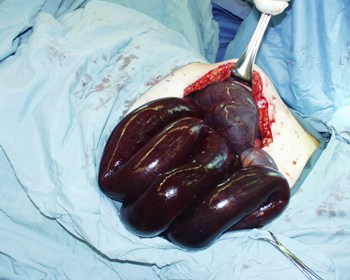 [Figure caption and citation for the preceding image starts]: 远端肠系膜疝中局部嵌顿缺血的小肠Daniel M. Herron, MD 提供 [Citation ends].
[Figure caption and citation for the preceding image starts]: 远端肠系膜疝中局部嵌顿缺血的小肠Daniel M. Herron, MD 提供 [Citation ends].腹内疝只能通过腔镜下或开放手术探查确诊。 治疗措施包括还纳肠管,切除坏死肠管。 用不可吸收缝线连续缝合所有疝孔。
吻合口溃疡
切口疝
胆石症
32%的由于减肥手术体重下降的患者会发生胆囊结石,并可能导致胆绞痛或急性胆囊炎。[69]
一些外科医生在行胃旁路术时会常规切除胆囊。 另一些医生只在患者明确有胆囊结石的情况下才进行切除。 但是,很多外科医生无论患者有没有胆囊结石,都不会切除无症状的胆囊。
在术后6个月内预防性地使用熊二醇(熊去氧胆酸)(口服,每日2次,每次300mg)可以把术后胆囊结石的发病率减少到2%到6%。[69][70]
胆囊结石的手术指征包括有症状的胆囊结石,急性或慢性胆囊炎或胆石性胰腺炎史。
由于胃旁路解剖结构的存在,无法行经内镜逆行胰胆管造影术,行胆囊切除术时应行胆管造影,以确认有无胆总管结石。
胃旁路术患者术后腹痛,即使诊断为胆囊结石,也不能排除腹内疝,外科医生常难以鉴别腹痛是由胆囊结石或腹内疝引起。 如果此时为患者行胆囊切除,需仔细评估胃旁路解剖情况,并修复所有腹内疝。
胃束带术是最不常进行的减重手术之一。通常需要进行与设备相关的再次手术,且费用很高。[71]
长期结局提示其减重效果低于胃旁路术或袖状胃切除术。[72]
几种可调节胃束带 (AGB) 装置已获得美国食品药品监督管理局的批准。它们通过限制胃容量发挥作用。
绝大多数可调节胃束带术都在腹腔镜下进行。 总的来说,只有在采取腔镜下无法完成的技术时,才会行开放性手术。 腹腔镜下经典的手术步骤包括,行5到6个5mm到15mm的戳口,构建腹腔镜手术通道。 然后,扩大其中一个切口以使注水池埋于腹壁皮下。
把可调节胃束带放置于胃上部周围,贲门以下。胃束带的体内部分包括一个环形气囊,通过皮下注水池注入生理盐水可使其膨胀。盐水容量在 4-15 mL 范围内,视具体设备而定。注水可绷紧束带,抽水可松弛束带。
总的来说,减肥外科医生通过绷紧束带来限制患者进食量,但是要防止束带过紧带来的呕吐、不适和食管扩张(假性贲门失弛缓症)。 生理盐水的注入量大约在4mL到15mL。
填充口通常在腹部 X 线平片下清晰可见,腹部查体时通常触及。
在放射影像学检查时,可见束带左高、右低,旋转约 20-40 度。角度不同的束带可能已从正常位置滑落。
调节束带容量之前需备皮,并用酒精或碘伏消毒皮肤。 用特殊的无芯Huber针穿刺,直达注水池。 用普通的中空针会导致注水池永久性损害。 如果体检无法扪及注水池,可以使用荧光镜引导。
在胃束带放置好以后胃要在内镜上,事先抽出患者胃束带中的部分或者全部生理盐水,才能在胃镜下行胃检查。
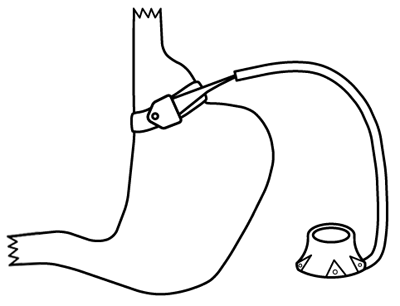 [Figure caption and citation for the preceding image starts]: 腔镜下可调节胃束带版权所有©2008 Daniel M. Herron, MD; 使用许可 [Citation ends].
[Figure caption and citation for the preceding image starts]: 腔镜下可调节胃束带版权所有©2008 Daniel M. Herron, MD; 使用许可 [Citation ends]. [Figure caption and citation for the preceding image starts]: 可调节胃束带位于正常位置时的上消化道造影。 虚线重叠于胃束带上以强调束带的正常角度,左侧的交角大约为水平线向上20到40度。 注意束带和膈膜之间的胃小囊。Daniel M. Herron, MD 提供 [Citation ends].
[Figure caption and citation for the preceding image starts]: 可调节胃束带位于正常位置时的上消化道造影。 虚线重叠于胃束带上以强调束带的正常角度,左侧的交角大约为水平线向上20到40度。 注意束带和膈膜之间的胃小囊。Daniel M. Herron, MD 提供 [Citation ends].
多达 8%的置有胃束带的患者可能发生注水器或连接管破裂。[75]
5%的患者会发生胃束带滑脱,或者称为胃脱出。[73] 腹部 X 线平片上可见胃束带左高、右低,与水平线大约呈 20-40 度夹角。角度不同的束带可能已从正常位置滑落。若发现束带偏向垂直位,提示胃后部脱出,束带向上滑脱,如果胃束带偏向水平位,则提示胃前部脱出。滑脱通常导致胃不完全性或完全性梗阻和腹痛。移除胃束带中的水可以缓解症状。若抽水后症状不缓解,则可能提示胃血供不足,需紧急行外科手术,以调整胃束带位置或移除胃束带。
对梗阻或腹痛的患者,需移除胃束带中的所有液体。 先体检扪及注水池,后用无芯 Huber针穿刺抽水。
胃束带偶尔会侵袭胃壁并导致感染。[76][77] 注水池附近蜂窝组织炎的患者须高度怀疑上述情况,因为细菌会沿注水管道蔓延,感染皮下组织和皮肤。胃壁侵袭可以通过胃镜诊断,治疗方法包括抗生素抗感染,立即移除胃束带。
使用胃束带的患者远期可能会出现食管扩张或食管增宽(假性贲门失弛缓症)。在初始可以减轻胃束带压力,之后必要时可移除胃束带。[78]
有些患者的注水池会发生扭转,导致皮下管道堵塞。 这种并发症需要外科翻修。 欧洲一项对1791名患者长达12年的研究证明,注水池相关的并发症的总发病率为11.2%。[79]
 [Figure caption and citation for the preceding image starts]: 可调节胃束带位于正常位置时的上消化道造影。 虚线重叠于胃束带上以强调束带的正常角度,左侧的交角大约为水平线向上20到40度。 注意束带和膈膜之间的胃小囊。Daniel M. Herron, MD 提供 [Citation ends].
[Figure caption and citation for the preceding image starts]: 可调节胃束带位于正常位置时的上消化道造影。 虚线重叠于胃束带上以强调束带的正常角度,左侧的交角大约为水平线向上20到40度。 注意束带和膈膜之间的胃小囊。Daniel M. Herron, MD 提供 [Citation ends].
胆胰转流术有时又被称为斯科皮纳罗氏手术(Scopinaro procedure),该术式适度地限制胃容量,同时引起明显的吸收不良。 胆胰转流术和Roux-en Y胃旁路术都限制了胃容量,并横断小肠进行了“Y形”重建。 但是与Roux-en-Y胃旁路术相比,胆胰转流术的胃小囊体积更大,肠管旷置更长,并且共同通道也更短(50cm到100cm)。 与胃旁路术相比,胆胰转流术胃容量限制程度较轻,吸收不良程度较重。
胆胰转流术通过切除胃窦部(胃窦切除术)减少胃容量。
胆胰转流术伴十二指肠转位是胆胰转流术的改进术式。 该术式切除了胃大弯,保留胃窦部。 这一步建立了容量为100mL到200mL的香蕉形“袖状胃”。 然后,于幽门下数厘米处横断十二指肠以建立胃小囊远端。 这一步改进可以减少倾倒综合征以及吻合口溃疡的发病率。
术后,上消化道内镜或肠镜无法进入胆胰支。无法施行经内镜逆行胰胆管造影术。
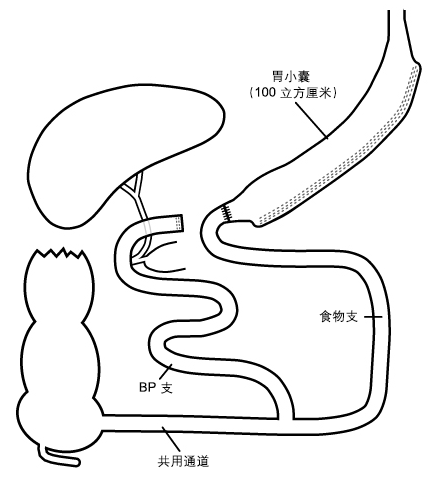 [Figure caption and citation for the preceding image starts]: 胆胰转流伴十二指肠转位术 (BPD-DS)版权所有©2008 Daniel M. Herron, MD; 使用许可 [Citation ends].
[Figure caption and citation for the preceding image starts]: 胆胰转流伴十二指肠转位术 (BPD-DS)版权所有©2008 Daniel M. Herron, MD; 使用许可 [Citation ends].
腔镜下袖状胃切除术(sleeve gastrectomy,SG),又被称为垂直袖状胃切除术(vertical sleeve gastrectomy),由于其技术简单,长期代谢影响小,现在开展得越来越普遍。[83][84][85][86] 一项随机前瞻性试验比较了 SG 与胃旁路术,发现两组患者术后 1 年时的体重减轻、并发症和生活质量情况相似。[87]
袖状胃切除术切除了胃大弯(左侧),建立了一个狭窄的香蕉形的胃通道。 该术式没有涉及小肠,因此食物的消化路径没有变化。
一些研究认为,袖状胃切除术的胃小囊内腔直径较大(40Fr/13mm或更大),因此瘘的发病率更低。[88]
与胃束带相比,袖状胃切除术具有几个显著的优点:减重效果更好;腹部没有植入异物;无需调整。基于这些原因和其他原因,许多外科医师认为,对于不能很好依从饮食或随访受限的高风险患者而言,该术式是最佳选择。
袖状胃切除术后,内窥镜可以进入胃的剩余部分。如果有需要,可进行经内镜逆行胰胆管造影术 (ERCP)。胃旁路术或胆胰转流术则不同,由于内窥镜无法进入大部分的胃或小肠,因此大多数情况下无法行常规 ERCP。
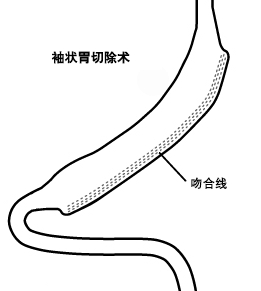 [Figure caption and citation for the preceding image starts]: 袖状胃切除术版权所有©2008 Daniel M. Herron, MD; 使用许可 [Citation ends].
[Figure caption and citation for the preceding image starts]: 袖状胃切除术版权所有©2008 Daniel M. Herron, MD; 使用许可 [Citation ends].
袖状胃切除术 (SG) 没有外科吻合口。但是,其长闭合端可能有发生瘘 (0.7%) 或出血 (0.7%) 的风险。[89][90] 与胃旁路术相比,袖状胃切术的闭合端瘘更难处理,但是可以通过胃镜下放置支架治疗。[91][92]
患者可能会于术后早期,大约1到2周时出现恶心、呕吐等症状。 这可能是术后水肿和胃扭转引起。 胃镜能改善这些症状,因其能轻度扩张并摆正胃小囊。 如果发现胃小囊明显狭窄,可行胃镜下球囊扩张。
顽固性恶心且排除机械性梗阻的患者,可行内科药物治疗。 一线抗恶心治疗应包括普鲁氯嗪或昂丹司琼。 如果以上治疗无效,可以使用抗抑郁药米氮平应对胃肠刺激效应。 此外,唾液吞咽困难的患者可以使用抗胆碱能药物莨菪碱。
术后,随着时间的推移,可能会出现袖状胃扩张,胃容量限制效果下降,进食量增加,体重恢复。 这种情况可能需要手术翻修。[93]
接受过袖状胃切除术的患者中,总体再入院率大约为 5%。[80]
一些研究认为,袖状胃切除术的胃小囊内腔直径较大(40Fr/13mm或更大),因此瘘的发病率更低。[88]
空回肠转流术是早期的常见减肥手术。 于19世纪50年代首次被提出。
该术式吻合近端空肠与远端回肠,从而有效地短路了小肠,减少吸收并旷置了一大段旁路小肠。
由于蛋白质营养不良、肝损害、电解质紊乱、肾结石等长期并发症严重,该术式已被淘汰。[94]
减重手术前筛查患者的微量营养素水平十分重要,因为减重手术前疆场存在一种或多种维生素或矿物质缺乏。[95]临床指南声称,由于减重手术导致胃容量限制和/或吸收不良,接受手术的患者发生营养缺乏的风险增加;[96] 然而,一项系统评价指出文献中关于减重手术后维生素 A、B₁、C 和 E缺乏的结果并不一致。[97]减重手术前后应对患者进行关于预期营养缺乏教育。[95]随访监测十分重要,因为数据表明营养缺乏的患病率正在增加。[95]
目前缺乏减重手术后标准营养支持方案。美国代谢和减重外科学会 (American Society for Metabolic and Bariatric Surgery, ASMBS) 发布了关于手术前后微量营养素筛查的指南,并建议使用补充剂预防手术后营养缺乏。[95] 美国临床内分泌医师协会 (American Association of Clinical Endocrinologists, AACE)、美国内分泌学会 (American College of Endocrinology, ACE) 和肥胖学会 (The Obesity Society, TOS) 联合发布了针对接受限制型或消化不良型手术患者的营养建议。[98] 此外,AACE、TOS 和 ASMBS 联合发布了关于围术期营养的临床实践指南。[81] 英国肥胖和代谢外科学会 (BOMSS) 发布了围手术期和术后营养指南。[82]
在胃旁路手术后,许多减重外科医师建议患者采用少量、高蛋白、低脂饮食,并补充多种维生素和矿物质。[99][100][101] 2017 年 ASMBS 指南建议患者服用维生素 B₁、B₁₂、D、A、E 和 K、叶酸、铁、钙、锌和铜补充剂。[95] 经典的胃旁路术后营养支持方案包括:
补充多种维生素(包括维生素 B₁、维生素 B₁₂ [氰钴胺] 和维生素 D)和铁,每日两次。咀嚼片的耐受性可能比吞咽片的更好。
铁补充:多聚糖铁复合物比硫酸亚铁更易耐受和吸收。
锌、镁和磷的补充:可作为口服多种维生素和矿物质补充的一部分。 补充锌可引起铜缺乏,反过来也是如此;因此,可能在补充锌的同时补充铜。
相对于非旁路手术而言,旷置了十二指肠或空肠的减肥手术(比如胃旁路术和胆胰转流术伴或不伴十二指肠转流),铁、钙和其他微量元素吸收障碍,因此需要补充更多的微量元素。 由于袖状胃切除术和可调节胃束带术没有旷置肠道,行该术式的患者只需要维持最低剂量的营养元素补充,例如每日补充复合维生素,不一定要补钙。
应强调的是,任何补充方案(例如上述的方案)仅仅是一个出发点,所有接受过减重手术的患者需要接受定期血液检查,以评估维生素状态。随后可根据需要为每例患者制定个体化补充方案。
各学会联合出版了大量指南,为接受过减肥手术的患者围手术期营养代谢支持提供了最优实践方案建议。[96][81][104][105][106]
特定手术方式和并发症相关的营养缺乏
减重手术后的严重呕吐可能导致维生素 B₁ 缺乏和 Wernick 脑病。神经症状包括共济失调、意识模糊和视物模糊。不应对此类患者静脉使用含葡萄糖的液体,以免造成永久性神经损伤。应使用加入了维生素 B1 和多种维生素的生理盐水和乳酸林格液 (Ringer's lactate solution)。[107]
吸收不良型手术由于旷置了大段的小肠,可能导致蛋白质缺乏。体格检查可发现患者水肿、脱发和无力。实验室检查可见低蛋白血症和贫血。Roux-en-Y 胃旁路术 (RGB) 后的发病率接近 13%,胆胰转流术伴十二指肠转位术 (BPD-DS) 后的发病率接近 18%。[99] 病情轻者可适当增加饮食蛋白质摄入。 病情重者需行全肠道外营养或手术翻修。
缺铁常见于旷置十二指肠的减肥术式,比如胃旁路术和胆胰转流伴十二指肠转位术。 发病率可达到50%。[99] 轻度缺铁可口服铁剂补铁,严重缺铁则需要静脉输注铁剂。
旷置近端小肠会导致维生素 B₁₂ 和叶酸缺乏。Roux-en-Y 胃旁路术 (RGB) 和胆胰转流伴十二指肠转位术 (BPD-DS) 后,通常推荐补充维生素 B₁₂ 和叶酸。维生素 D 缺乏也十分常见,其与钙缺乏和继发性甲状旁腺功能亢进有关。[108][109] 可通过补充枸橼酸钙和维生素D治疗。适度的日晒也有助于治疗。
锌缺乏症常见于 BPD-DS 术后,可能是由于这种手术操作后的脂肪吸收不良。[106] 锌缺乏症也可见于胃旁路手术后,但与 BPD-DS 相比较少见。
镁缺乏症可能见于 BPD-DS 和胃旁路手术后,但在 BPD-DS 术后更常见。[106] 有趣的是,一项研究发现,在胃旁路手术后 1 年,患者的镁浓度增加。[110]
减重手术导致骨密度降低,并对骨代谢产生不良影响。[113][114][115][116] 吸收不良型手术后的风险大于限制型手术。[117]目前认为脂肪量减少、钙和维生素 D 吸收不良、体重减轻后机械负荷降低、营养摄入减少、缺乏运动以及激素和代谢情况变化都会影响减重手术后的骨代谢。[118][115][113]一项针对 10 项研究的 Meta 分析发现,III 级肥胖患者接受减重手术后骨密度显著下降,骨转化率增加,骨重建加速。[116]研究发现减重手术后骨转化率增加与体重指数改变[119] 以及骨密度降低有关,但与体重无关。[120]另一项研究发现,与接受强化药物治疗的糖尿病患者相比,接受减重手术的糖尿病患者的骨转化率长期升高(术后 5 年)。[121]
与非手术对照组相比,所有类型的减重手术都能降低股骨颈骨密度。[122]手术不会降低腰椎的骨密度。[122]Roux-en-Y 胃旁路术和袖状胃切除术均与术后一年髋关节和腰椎骨密度下降有关。[114]与袖状胃切除术相比,Roux-en-Y 胃旁路术会导致更严重的股骨颈和全髋关节骨密度损失;然而,袖状胃切除术后椎骨和股骨骨髓脂肪组织增加(可能损害骨骼健康),体重减轻和内脏脂肪减少幅度较低。[114]
手术对骨和矿物质代谢的影响各有不同,具体取决于手术方式(Roux-en-Y 胃旁路术、可调节胃束带手术或袖状胃切除术),持续时间超过术后一年。[113]建议密切监测和补充钙和维生素 D,以防止减重手术后出现继发性甲状旁腺功能亢进和骨质流失。[116]
10% 或更多的减肥手术患者可能会发生体重减轻不足或体重反弹的情况。[46][128][129][130] 这可能由于不完整的外科解剖结构所致,或者可能是由于更复杂的心理和行为因素。多项研究发现术后时间较长、年龄较轻、对食物欲望的控制不充分、成瘾行为、术后健康状况下降是术后体重反弹的可能预测因素。[27][131]
初始评估
评估体重减轻不充分或体重反弹的患者需要系统方法。
初步评估需要详细的营养史和活动史。 这应当包括全面评估术后对饮食、营养补充、锻炼和随访方案的行为依从性。
行上消化道造影和胃镜检查以评估手术相关解剖结构,确保手术干预后仍然完好。
如果患者有完整的外科解剖结构,尽管在术后依从饮食、营养补充和锻炼方案,但体重减轻不充分或体重反弹,可以考虑体重减轻药物治疗。[131][132][133]
手术解剖结构异常
行上消化道造影、胃镜检查后可能会发现外科解剖改变。 例如:
Roux-en-Y 胃旁路术 (RGB) 后胃囊过大(估计容量>30 mL)。这通常导致体重恢复,原因是胃容量限制作用下降,还可能导致呕吐,这是由于胃囊排空障碍。
胃旁路术后,胃-胃瘘管形成。 这常导致吻合溃疡和体重恢复。
胃从胃束带中脱出,导致胃小囊过大。
对于手术解剖结构不理想导致的减重失败,通常需要再次手术,重建期望的手术解剖结构。减重翻修手术的并发症发生率和死亡率均远高于初次手术的。
监测
长期进行常规的自我监测和频繁的术后随访可能帮助患者维持减肥手术后的体重减轻。[27]
接受过减肥手术的患者腹痛处理方法:
初步评估和处理后,应该立即联系患者的手术医生或请减肥外科专科医生会诊。
明确手术日期,因为术后不同时期,导致疼痛的原因也各不相同。
全血细胞分类计数有助于明确是否存在感染、炎症或出血。曾经有进食困难的患者需接受血电解质检查。淀粉酶/脂肪酶和肝功能检查有助于诊断胰腺炎、胆囊炎或和其他肝胆疾病。行吸收不良型手术的患者需接受凝血功能检查,因为维生素 K 缺乏会导致凝血酶原时间增长。
对于术后 2 周内新发的腹痛,需警惕肠瘘的可能,特别是闭合端和吻合口瘘。口服对比剂后行计算机体层成像 (CT) 扫描有助于发现肠瘘、腹腔积液或脓肿。采用水溶性对比剂的上消化道造影对发现胃或近端空肠瘘极为有帮助,但对发现远端消化道瘘的帮助没有那么大。一般来说,肠瘘一经发现,需立即返回手术室,进行冲洗、修复瘘道、放置引流管以及放置肠内饲管。如果患者病情稳定,对于包囊良好的泄露,偶尔可以通过非手术方法治疗。
减肥手术后 3 个月或更长时间发生上腹痛或右上腹部疼痛提示胆囊炎或吻合口溃疡。 腹部超声是评估胆囊的首选检查。 通过胃镜可以发现胃炎或吻合口溃疡。
胃束带患者出现急性腹痛,可能是急性胃束带滑脱或胃脱垂,可通过上消化系统 X 线检查确诊。
术后3个月或以上的患者出现腹痛,常提示腹内疝。 虽然CT扫描可以发现腹内疝,但发现率不高。 若怀疑腹内疝,应立即外科会诊以明确是否行手术治疗。
缺乏任何前兆症状的突发疼痛高度提示吻合口或残余胃溃疡穿孔。
上腹部慢性间歇性痛,并放射至背部,高度提示腹内疝,如果能排除其他来源的腹痛,应行外科手术探查以明确诊断。
接受过减肥手术的患者恶心和呕吐处理方法:
胃旁路术后首周出现恶心、呕吐提示吻合口水肿,常能自发缓解。 如果术后2周以上出现恶心、呕吐,提示吻合口狭窄可能性大。 以上情况可通过胃镜确诊,通过球囊扩张术治疗。
如果胃束带患者出现恶心和呕吐,应立即松解束带。如果这不能缓解症状,应立即行上消化道造影,以评估有无持续性梗阻,后者提示胃束带滑脱或胃脱垂。
袖状胃切除术的患者术后常出现恶心、呕吐。 胃镜检查可明确是否存在机械性肠梗阻,还可通过轻柔地扩张水肿或扭转的袖状胃起到治疗作用。
使用此内容应接受我们的免责声明。
