具体信息
甲状腺激素包括甲状腺素(T4)和三碘甲腺原氨酸(T3),由甲状腺合成、储存和分泌。 这些激素,特别是T3在多种生物代谢过程中扮演重要角色。 甲状腺激素通过与几乎分布在体内所有器官中的甲状腺激素受体结合发挥作用。 一般来说,这个过程调控基因转录和后续多种参与发育、生长和细胞代谢的蛋白质的合成。[1] 甲状腺功能测试是最常用的内分泌测试。American Thyroid Association: thyroid function tests
下丘脑和脑(下)垂体调节甲状腺激素的合成。 下丘脑促甲状腺激素释放激素(TRH)刺激脑垂体促甲状腺激素(TSH)的合成和分泌, 而TSH刺激甲状腺产生和释放T4和T3。 一旦T4和T3被释放,就会对TRH和TSH的生成形成负反馈。[1]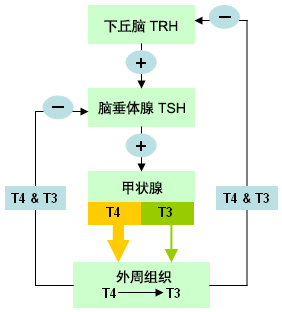 [Figure caption and citation for the preceding image starts]: 下丘脑-脑垂体-甲状腺轴Dr Sheikh-Ali收集整理 [Citation ends].
[Figure caption and citation for the preceding image starts]: 下丘脑-脑垂体-甲状腺轴Dr Sheikh-Ali收集整理 [Citation ends].
甲状腺产生并应用甲状腺球蛋白(Tg)来合成T4和T3。 T3是具有生物学活性的甲状腺激素,而T4则被认为是T3的激素原。 循环中全部的T4和20%的T3由甲状腺产生, 剩余80%的T3在外周组织中由T4转化而来。 各种急性病以及某些药物可能抑制T4向T3的转化,从而影响它们的血清水平。
T4和T3通过与蛋白质结合在外周血中循环,这些蛋白质包括甲状腺素结合球蛋白(TBG)、前清蛋白(甲状腺素运载蛋白)和清蛋白。 大约99.98%的T4和97%的T3与蛋白质结合。 只有未结合或“游离”的部分——游离T3(FT3)和游离T4(FT4)——具有活性。 所以,任何甲状腺激素结合蛋白的质或量的改变都会引起循环中甲状腺激素水平的变化。[1]
美国和英国的人群研究表明,临床(显性)甲减的发病率为0.1%~2%,亚临床甲减在成人中的发病率为4%~10%,老年女性更易发病。 美国的甲亢发病率约为1.2%(0.5%临床甲亢和0.7%亚临床甲亢);最常见原因包括Graves病,毒性多结节性甲状腺肿以及毒性腺瘤。[2][3]
在美国,美国甲状腺协会建议人们从35岁开始检测血清TSH浓度,之后每5年检测1次。[4] 然而,美国预防服务工作组发现支持或反对成人甲状腺疾病常规筛查的证据并不充分。[5] 在英国,在健康人群中筛查甲状腺疾病目前尚未实施。[6]UK guidelines for the use of thyroid function tests
在甲状腺功能失调高危人群中进行筛查或许更为恰当。 以下患者应考虑进行筛查和后续监测:[7][8][9][10]
伴甲状腺肿
影响甲状腺的手术史或放射治疗史
垂体或下丘脑疾病、手术史或放射史
伴1型糖尿病
伴Addison病
一级亲属中有自身免疫性甲状腺疾病者
伴白癜风
伴恶性贫血
伴白发(早发灰发)
伴精神障碍
接受药物或含碘剂治疗者(如盐酸胺碘酮、放射性造影剂、含碘化钾的祛痰剂、海藻、α-干扰素、酪氨酸激酶抑制剂、尤其是舒尼替尼)
伴唐氏综合征或特纳综合征。
有明确甲减史的患者如果想要怀孕,要升高其甲状腺激素水平,使血清TSH值低于2.5mIU/mL, 这样可以减少其妊娠早期TSH上升的风险。[11]
妊娠期,雌激素水平增加,甲状腺结合球蛋白浓度也会增加,从而引起T4和T3水平升高。 妊娠早期,由于人绒毛膜促性腺激素(hCG)的影响,血清TSH水平会下降,而hCG与游离T4的短暂轻微升高可能也有关联。 这些变化都很轻微。 在大多数妊娠妇女中,FT4浓度常维持在非妊娠妇女的正常范围内。[12] 在妊娠中期和晚期,FT4和FT3减少,有时甚至低于非妊娠妇女参考值。 支持或反对对妊娠期妇女中进行筛查的证据并不充分。
就对妊娠期甲状腺功能失调进行检测和治疗而言,相较于病例搜索,普遍筛查并无法减少不良结局的出现。[13] 然而,内分泌学会建议对甲状腺功能失调高风险人群进行筛查,即有以下情形的妇女:[14]
年龄>30岁
近期接受左旋甲状腺素替代治疗
生活在碘缺乏区
甲亢或甲减史,产后甲状腺炎史,甲状腺腺叶切除史
甲状腺病家族史
甲状腺肿
甲状腺抗体(已知)
有提示性的甲状腺功能低下或亢进的症状和临床迹象,包括贫血,胆固醇升高,低钠血症
1 型糖尿病
其他自身免疫疾病
头部或颈部放射治疗史
先前有流产或早产史
不孕:TSH筛查应作为不孕症检查项目之一
对于有甲状腺功能减退的孕妇,应密切监测甲状腺功能检测 (TFT),因为在妊娠早期,甲状腺素替代量经常需要增加 20%-30%。[15] 甲状腺素需滴定给药,以维持血清TSH浓度在妊娠早期为0.1-2.5mIU/mL,妊娠中期为0.2-3mIU/mL,妊娠晚期为0.3-3mIU/mL[11][13] 妊娠期监测应包括每4周检查一次TSH,直至20孕周,26和32孕周时至少测1次。产后,甲状腺剂素量应减至妊娠前水平,6周后重测TSH值,如有需要,调整甲状腺素用量。[11]
TSH检查
在缺乏下丘脑和脑垂体病理学支持下的情况下,可以用血清TSH检测筛查甲状腺功能紊乱。[4][16][17][18] 在大多数的参照试验室中,TSH正常范围为0.45-4.5mIU/L[19] TSH对血浆甲状腺激素浓度的变化相当敏感。[20] TSH可能需要平均6-8周的调整,以适应甲状腺激素水平发生的变化。 因此,甲状腺素剂量调整或抗甲状腺素药物治疗6-8周后,才建议进行TSH水平检测。 低TSH水平时需检测FT4。 如无升高,需检测FT3水平以鉴别是否为T3型甲状腺毒症。 TSH被抑制或升高可证实甲状腺功能异常,但无法证实其原因。 罕见情况下,TSH 改变是由异嗜性抗体(小鼠 IgG 抗体或其他人抗小鼠单克隆抗体 [HAMA])的检测干扰引起的。 这可能引起假性的低或高 TSH 结果,尽管通常会引起血清 TSH 增高。 使用不同的商业检测方法的重复 TSH 检查可中和异嗜性抗体的作用。[19]
游离T4(FT4)和游离T3(FT3)测定
FT4测定用于评估异常TSH水平, 优于总T4测定。 游离T3测定优于总T3测定;然而,一些市售游离T3检测产品多种多样,效果不可靠。 FT3测定应用于评估甲状腺毒症患者,在TSH低于正常值但FT4未见升高时也适用。 FT4和FT3测定是是检测甲状腺产出的好方法,不受甲状腺激素结合球蛋白浓度的影响。 一般来说,FT4正常范围是12-30pmol/L(0.9-2.3ng/dL),FT3正常范围是2-7pmol/L(230-420pg/dL)。[1]
总T4和总T3测定
在FT4和FT3测定改良前,总T4和总T3测定用于评估TSH测定异常。 然而,总T4和总T3水平会受循环中甲状腺激素结合蛋白水平变化的影响, 它测定的是游离和与蛋白结合的激素量。 总 T4 的正常范围在 206-309 nmol/L (5.5-12.5 μg/dL)),总 T3 的正常范围在 0.92-2.76 nmol/L (60-180 ng/dL)。
妊娠、雌激素的使用、肝脏疾病(如肝炎)、药物应用(如三苯氧胺、美沙酮)及罕见遗传性甲状腺结合球蛋白升高等可引起甲状腺结合球蛋白升高,导致总T4和总T3水平升高。[21][22] 其他可导致总T4和总T3水平升高的罕见情况包括清蛋白或甲状腺素运载蛋白结合增加。
雄激素过量、糖皮质激素过量、肾病综合征、遗传性甲状腺结合球蛋白缺乏及药物应用(如烟酸、达那唑)等可引起甲状腺结合球蛋白降低,导致总T4和总T3减少。[22][23][24]
疾病、饥饿、营养不良导致清蛋白和甲状腺运载蛋白水平降低,并可能影响运载蛋白结合能力,从而导致总T4和总T3水平下降。
甲状腺自身抗体
TSH受体抗体(TRAb)并非常规测定指标,但可用于病例诊断不明确的情况。 其结果有助于甲状腺疾病的病因鉴定。 TRAb可刺激或阻断TSH受体。 甲状腺刺激性免疫球蛋白(TSI)即为一种刺激型TRAb,在Graves病中常可见升高。
甲状腺过氧化物酶抗体(TPOAb)也有助于甲状腺疾病的病因鉴别。 TPOAb常可见于桥本病和其他自身免疫性甲状腺疾病。
Tg抗体测定主要用于涉及甲状腺的自身免疫性疾病的诊断。
由于TRAb可自由通过胎盘,刺激胎儿的甲状腺,TRAb测定应该用于孕龄22周、有Graves病既往史或现病史、既往有Graves病产儿或既往有TRAb升高情况的孕妇。[14]
Tg测定
常用于监测血清中无Tg自身免疫性抗体的分化型甲状腺癌患者。
此外,还可用于甲亢潜在病因的调查, 在原发性甲亢和原发性甲状腺炎患者中,Tg含量常升高,但在人为甲状腺毒症患者(由甲状腺激素药物的过量使用而引起)中并不升高。
在33%~88%的甲状腺细针穿刺活检(FNB)患者中可见血清Tg升高, 其浓度一般在穿刺活检后约2-3周回到基线水平。 穿刺活检后血清Tg升高水平差异很大(35%~341%),不可作为取活检结节为良/恶性的预测因子。[25]
放射性碘摄入及扫描
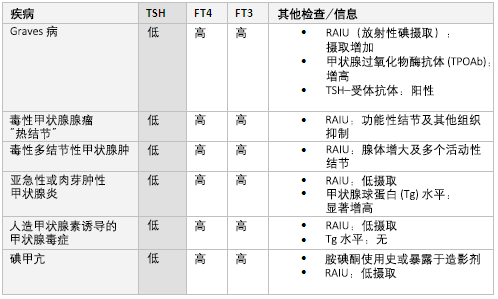
通常在甲状腺毒症时进行检测,用于确定潜在病因。 它用于测量甲状腺对放射性碘(常用I-123)的摄取量。 高摄入或提示甲亢, 在Graves病中,可见摄入量呈均匀弥散增加,或呈现出多结节性毒性甲状腺肿中所见的热结节样外观。 在适当的临床背景中,低摄入量或提示甲状腺炎或人为甲状腺毒症。
RAIU不可用于某些患者(如妊娠或哺乳期妇女或碘污染患者)。在此情况下,血清TRAb测定有助于Graves病的鉴别。
TRH刺激试验
用于评估中枢性甲减中TSH对TRH刺激的反应, 有助于区分TSH分泌瘤和甲状腺激素抵抗综合征(RTH)。 RTH中,TSH反应正常。 TRH刺激试验是非特异性试验。
降钙素
提示甲亢。 最常见原因包括Graves病、毒性多结节性甲状腺肿、毒性腺瘤及甲状腺炎。[28] RAIU有助于鉴别以上疾病。 Graves病中,RAIU呈弥散性增加。 毒性甲状腺结节,单个结节区域的摄入量增加,或毒性多结节性甲状腺肿中出现多个区域摄入量增加,其余甲状腺组织摄入被抑制。 此外,在Graves病中,虽然通常不是诊断要求检测的指标,但约90%的患者会出现甲状腺刺激免疫球蛋白。
在亚急性或肉芽肿性甲状腺炎中,RAIU值偏低。 亚急性甲状腺炎患者甲状腺中存储的T3、T4过量释放,导致患者最初甲状腺激素水平升高, 随后,炎症消退时,在回归正常值前,甲状腺激素会低于正常水平。
其他原因包括人为甲亢(甲状腺激素用药过量所致)或碘源性甲亢(如使用胺碘酮或暴露于放射性造影剂后)。 前者有甲状腺球蛋白水平和RAIU值都偏低,后者也有RAIU值偏低。
 [Figure caption and citation for the preceding image starts]: 低TSH联合高游离T4(FT4)和/或游离T3(FT3)的原因鉴别Dr Sheikh-Ali收集整理 [Citation ends].
[Figure caption and citation for the preceding image starts]: 低TSH联合高游离T4(FT4)和/或游离T3(FT3)的原因鉴别Dr Sheikh-Ali收集整理 [Citation ends].
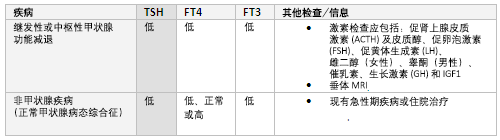
提示继发性(中枢性)甲减,一种与下丘脑或脑垂体功能异常有关的疾病。 TSH值可偏低、正常或轻度升高, 影像学检查(垂体MRI)之前应评估其他垂体激素是否分泌不足。 激素检测应包括:ACTH(皮质醇)、FSH、促黄体生成素、雌二醇(女性)、睾酮(男性)、催乳素、生长激素和胰岛素样生长因子1(IGF1)。 对于这种情况需测定FT4和FT3水平以监测甲状腺替代治疗情况。[29]
其他引起相同结果的原因包括非甲状腺疾病[正常甲状腺功能病态综合征(SES)],出现急性系统性疾病后甲状腺功能检出异常,但并不存在真正的甲状腺功能失调。 在急性疾病恢复期,TSH可正常或偏低,此后会有升高。[19] FT4可正常、偏低或偏高。 随着T4向T3转化减少,FT3常偏低。 此种情形不建议甲状腺激素替代治疗。[30][31]
在妊娠中期和晚期,FT4和FT3量减少,有时会低于非妊娠妇女参考值。
 [Figure caption and citation for the preceding image starts]: 低TSH联合低游离T4(FT4)和/或游离T3(FT3)的原因鉴别Dr Sheikh-Ali收集整理 [Citation ends].
[Figure caption and citation for the preceding image starts]: 低TSH联合低游离T4(FT4)和/或游离T3(FT3)的原因鉴别Dr Sheikh-Ali收集整理 [Citation ends].
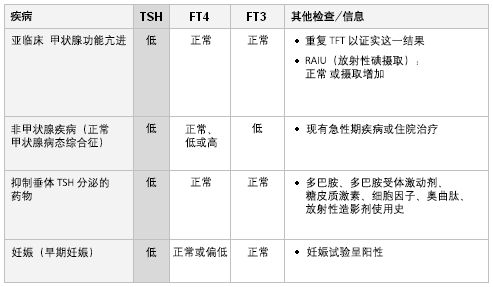
在未患非甲状腺疾病或接受相关药物治疗的情况下,此结果提示亚临床(轻度)甲亢。 这种病例中,RAIU可轻微升高或正常。
在非甲状腺疾病(正常甲状腺功能病态综合征)中,急性疾病恢复期,TSH可正常或偏低,此后会有升高。[19] FT4可正常、偏低或偏高。 随着T4向T3转化减少,FT3常偏低。
以下药物可产生此结果:多巴胺、多巴胺能激动剂、糖皮质激素、细胞因子或奥曲肽,原因是它们可抑制垂体TSH分泌。 暴露于放射性造影剂中也会产生类似结果。[32][33]
近期应用抗甲状腺药物治疗甲亢也会引起相同结果。 在接受治疗之后,TSH至少需要6-8周来调整。[34]
在妊娠早期,由于hCG的作用,血清TSH值下降, 这或许与轻度短暂的FT4升高相关。[12]
 [Figure caption and citation for the preceding image starts]: 低TSH联合正常游离T4(FT4)和/或游离T3(FT3)的原因鉴别Dr Sheikh-Ali收集整理 [Citation ends].
[Figure caption and citation for the preceding image starts]: 低TSH联合正常游离T4(FT4)和/或游离T3(FT3)的原因鉴别Dr Sheikh-Ali收集整理 [Citation ends].非洲裔美国人相比白人,其正常的 FT4 和 FT3 可能具有略低的 TSH 参考范围。[35]
出现此种结果,首先应该考虑人为/试验室误差。 改变实验方法有助于弄清问题。[36]
如果实验结果无误,则主要诊断应为垂体TSH分泌瘤或甲状腺激素抵抗综合征。 血清中性激素结合蛋白(SHBG)和循环游离α亚基升高及其他垂体激素分泌过量或不足的异常支持TSH分泌瘤的诊断。[37] 垂体影像学检查(MRI)可确诊,但需适当的生物化学证据支持。 RAIU呈弥散性增加。
依据阳性家族史,脑垂体MRI未检出腺瘤、血清α亚基水平正常,则甲状腺激素抵抗综合征可被确诊。 垂体TSH分泌瘤中,TSH自发生成,与之相比,甲状腺激素抵抗综合征中,T4或T3最终抑制高TSH的产生。[38][39][40]
TFT监测数小时内的甲状腺素替代治疗(针对疑似甲减患者)可使FT4水平升高, 而FT3水平几乎总是保持正常。[41]
急性精神障碍患者也可出现甲状腺功能异常。[42]
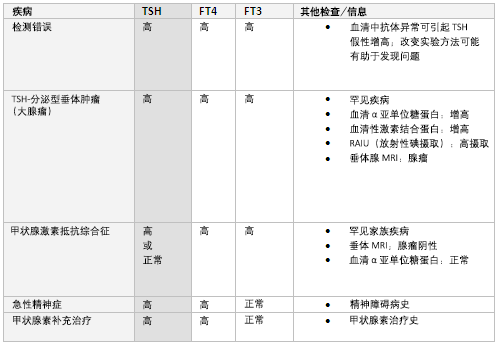 [Figure caption and citation for the preceding image starts]: 高TSH联合高游离T4(FT4)和/或游离T3(FT3)的原因鉴别Dr Sheikh-Ali收集整理 [Citation ends].
[Figure caption and citation for the preceding image starts]: 高TSH联合高游离T4(FT4)和/或游离T3(FT3)的原因鉴别Dr Sheikh-Ali收集整理 [Citation ends].
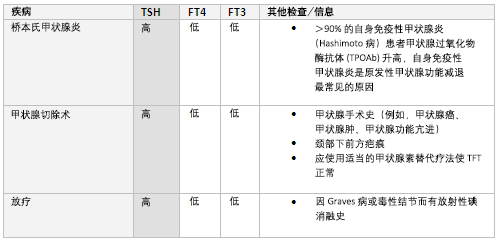
提示原发性甲减。 伴随有甲状腺激素(T4和T3)合成不足的自身免疫性甲状腺炎(桥本病)是原发性甲减的最常见原因, 超过90%的桥本病患者TPOAb阳性。
其他原因包括甲状腺切除术、甲状腺放射性碘治疗且未进行足量的甲状腺激素替代治疗。
 [Figure caption and citation for the preceding image starts]: 高TSH联合低游离T4(FT4)和/或游离T3(FT3)的原因鉴别Dr Sheikh-Ali收集整理 [Citation ends].
[Figure caption and citation for the preceding image starts]: 高TSH联合低游离T4(FT4)和/或游离T3(FT3)的原因鉴别Dr Sheikh-Ali收集整理 [Citation ends].
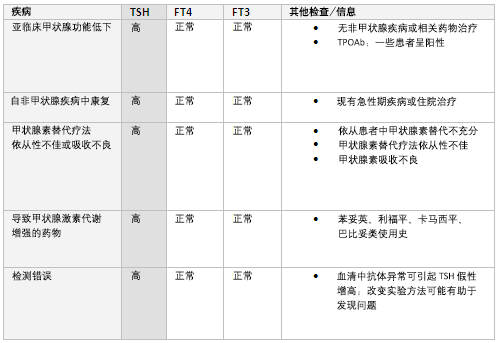
TSH超出正常参考值范围而FT4和FT3正常时,提示亚临床(轻度)甲减, 其发展为临床(显性)甲减的风险每年为2%~5%。[43] TPOAb阳性患者风险更高。[44] 有关治疗尚存争议, 一般而言,TSH低于10mIU/L时,不建议甲状腺素替代治疗。[45] 对未经治疗患者,每隔6-12个月应重复检测TSH和FT4,以监测甲状腺状态有无改善或恶化。[43]
鉴别应包括非甲状腺疾病(正常甲状腺功能病态综合征)恢复期。 在急性疾病恢复期,TSH可正常或偏低,此后会有升高。[19]
其他鉴别包括甲状腺素替代疗法依从性差或吸收障碍:例如乳糜性口炎性腹炎,或是因与其他药物共同使用(例如碳酸钙、硫酸亚铁和考来烯胺)造成的干扰。
同服促甲状腺激素代谢的药物(如利福平、苯妥英、卡巴咪嗪、巴比妥类)可导致相同结果。[19]
此外,实验进程中产生的问题(如血清异常抗体的干扰)也可导致TSH假增高, 改变实验方法可能有助鉴别。[36]
 [Figure caption and citation for the preceding image starts]: 高TSH联合正常游离T4(FT4)和/或游离T3(FT3)的原因鉴别Dr Sheikh-Ali收集整理 [Citation ends].
[Figure caption and citation for the preceding image starts]: 高TSH联合正常游离T4(FT4)和/或游离T3(FT3)的原因鉴别Dr Sheikh-Ali收集整理 [Citation ends].
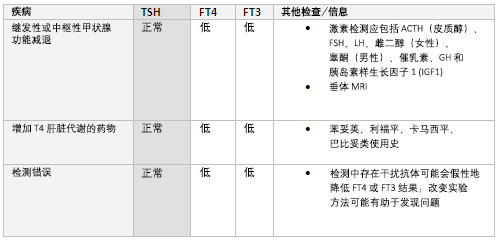
与垂体或下丘脑功能异常相关的继发性(中枢性)甲减可导致该结果, TSH值可偏低、正常或轻度升高, 影像学检查(垂体MRI)之前应评估其他垂体激素是否分泌不足。 激素检测应包括ACTH(皮质醇)、FSH、促黄体生成素、雌二醇(女性)、睾酮(男性)、催乳素、GH和胰岛素样生长因子1(IGF1)。 对于这种情况需测定FT4和FT3水平以监测甲状腺替代治疗情况。[29]
其他原因包括药物使用(例如苯妥英、利福平、卡马西平、巴比妥类)及干扰物引起的检测误差。
 [Figure caption and citation for the preceding image starts]: 正常TSH联合低游离T4(FT4)和/或游离T3(FT3)的原因鉴别Dr Sheikh-Ali收集整理 [Citation ends].
[Figure caption and citation for the preceding image starts]: 正常TSH联合低游离T4(FT4)和/或游离T3(FT3)的原因鉴别Dr Sheikh-Ali收集整理 [Citation ends].
许多常用药物都可影响甲状腺功能。[45] 因此,在涉及患者的治疗时,需考虑到这些药物对TFTs结果和治疗效果可能产生的影响。
碘剂、胺碘酮或锂剂可增加或减少甲状腺激素的分泌。
多巴胺及其激动剂、糖皮质激素、细胞因子或奥曲肽可减少TSH分泌。
利福平、苯妥英、卡马西平或巴比妥类可增强肝脏的代谢。
卡比马唑、丙硫氧嘧啶或锂剂可减少甲状腺激素合成。
β受体阻滞剂、糖皮质激素、胺碘酮、丙硫氧嘧啶或放射性造影剂可减少T4向T3的转化。
呋塞米、非甾体抗炎药、甲灭酸、卡马西平或 β 受体阻滞剂可从血浆蛋白中置换出 T4/T3。
雌激素、他莫昔芬、海洛因、美沙酮或雷洛昔芬可增加甲状腺结合球蛋白、总T4、总T3水平。
雄激素、促蛋白合成类固醇或糖皮质激素可减少甲状腺结合球蛋白、总T4、总T3水平。
考来烯胺、氢氧化铝、硫酸亚铁、硫糖铝、碳酸钙或质子泵抑制剂可损害甲状腺素的吸收。
白介素1、α-干扰素、β-干扰素和TNF-α有引起自身免疫性甲状腺功能失调的风险。
胺碘酮也可能改变甲状腺激素的作用。
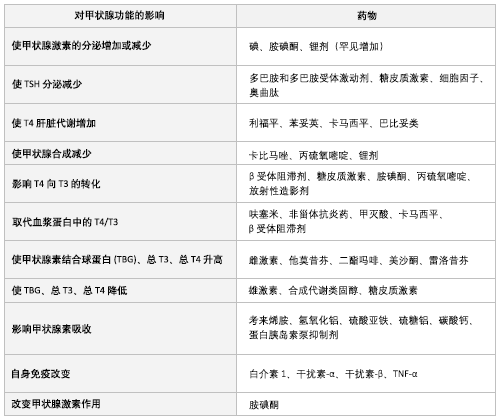 [Figure caption and citation for the preceding image starts]: 药物对甲状腺的影响Dr Sheikh-Ali收集整理 [Citation ends].
[Figure caption and citation for the preceding image starts]: 药物对甲状腺的影响Dr Sheikh-Ali收集整理 [Citation ends].
使用此内容应接受我们的免责声明。
