具体信息
在美国,每年约有 2700 万患者接受非心脏外科手术。[1] 其中约 5 万患者存在围手术期心肌梗死 (myocardialinfarction, MI)。而且,每年 4 万例围手术期死亡病例中,超过一半由心脏事件导致。[2] 年龄>65岁的患者发生心脏疾病、心脏并发症和死亡的风险更高。考虑到在未来数十年间这一患者人群的数量将大幅增加,可以预见的是,在全球范围内,行非心脏手术且存在较高围手术期心脏风险的患者数量将显著增加。
大多数围手术期心脏并发症和心源性死亡与 MI、心力衰竭或心律失常有关。因此,术前评估和围手术期管理应侧重于对相应患者针对冠心病 (coronary artery disease, CAD)、左心室 (left ventricular, LV) 收缩功能不全和严重心律失常进行检测、特征识别和治疗。这些患者包括已确诊或疑诊 CAD、心律失常、有心力衰竭病史或存在相应症状的患者。对于年龄≥50 岁的患者,需要采集更详细的病史,并进行更详尽的体格检查。
评估患者的疾病状况和择期非心脏手术可能带来的心脏风险
为降低整个围手术期心脏问题的风险以及改善远期心脏结局,提供适当的策略。
评估的主要目标是:
发现围手术期不良心脏事件发生风险增加的患者
发现因心血管疾病而有较差远期预后的患者。即使接受非心脏手术时,患者发生心脏事件的风险不高,恰当的治疗也可能影响远期预后。
评估性质应个体化,需要根据患者和特定临床情境决定。
对于需接受急诊手术的患者,只需进行快速术前评估,此后的管理目标主要针对防止或最大程度降低发生心脏并发症和死亡的风险。更全面的评估大多可在术后进行。
对于拟接受择期手术(无紧急手术指征)的患者,可以进行更全面的术前评估。
实现最佳围手术期结局的八个步骤(如下)[6]
1. 评估临床特征
病史和查体应该有助于识别心脏风险标志物以及评估患者的心脏状态。
高风险心脏疾病包括近期发生 MI、失代偿性心力衰竭、不稳定型心绞痛、有症状的心律失常和有症状的瓣膜性心脏病。[7]
2. 评估功能状态
能够进行规律运动且无活动耐量受限的患者一般有充足的心血管功能储备,能够耐受手术冲击。
3. 考虑外科手术的特定风险
外科手术的种类对围手术期风险有重要的影响。根据风险高低,非心脏外科手术可分为高风险、中等风险和低风险(参见下文“根据非心脏外科手术的种类进行的风险分层”)。
4. 决定是否需要进一步实施无创性评估
根据临床特征和功能状态判定为低心脏风险的患者,如果接受低风险手术,一般不需要行进一步评估。
根据临床特征判定为存在高心脏风险的患者,如果功能状态差,并且已被考虑接受高风险非心脏外科手术,则进一步评估可能有益。
5. 决定何时推荐进行有创性评估
手术前行冠状动脉血管造影的指征与非手术情况下的类似,包括无创检测后认为具有高心脏风险的患者、足量药物治疗无效的心绞痛患者、不稳定型心绞痛患者、无创性检查结果不明确但需要接受中等风险或高风险非心脏外科手术的患者。
稳定型CAD患者通常不需要接受冠状动脉造影和血运重建。
6. 最佳化药物治疗
患者应接受最优化的药物治疗,包括围手术期及术后长期,具体治疗取决于患者的基础心脏疾病。
7. 进行适当的围手术期监测
对于已知或疑似 CAD 的患者,可以依据心肌损伤生物标志物升高的幅度、新发 ECG 异常改变、血流动力学不稳定、胸痛的性质和严重程度或者其他症状,预估围手术期发生心肌缺血或 MI 的可能性。
8. 计划最大程度的长期治疗方案
对高脂血症、吸烟、高血压、糖尿病、活动减少、周围血管疾病、心脏杂音、心律失常、传导异常和(或)围手术期心肌缺血进行评估,可以使患者接受恰当的治疗和评估,从而降低未来心血管事件风险。
采集病史的目的在于:
发现心脏疾病(例如近期新发或陈旧性心肌梗死、失代偿性心力衰竭、既往不稳定型心绞痛、明显的心律失常、心脏瓣膜病)
发现严重合并症(例如糖尿病、周围血管疾病、卒中、肾功能不全、肺部疾病)
判断患者的功能储备
记录目前所有的用药情况、过敏史、吸烟史和锻炼习惯。
体格检查方面,重度主动脉瓣狭窄、颈静脉压升高、肺水肿和(或)有第三心音的患者手术风险较高。
现已表明,患者完成日常活动的功能储备与平板运动试验的最大摄氧量密切相关。[4] 能量代谢当量 (metabolic equivalent of a task, MET) 是一个生理学概念,表示完成体力活动耗费的能量。MET的参考值如下。评估时,患者的功能储备<4 MET时,认为其功能储备差,有相对较高的围手术期不良事件发生风险;患者的功能储备>10 MET时,即使患者已患有 CAD,仍认为其功能储备良好,围手术期不良事件的发生风险极低。功能储备为4-10 MET时,认为功能储备尚可,围手术期不良事件的发生风险较低。
1 MET
进食、穿衣、如厕
室内行走
平地步行时速度大概保持在3.2 km/h
从事较轻的家务劳动,例如洗碗。
4 METs
爬1层楼(通常为18-21级台阶)
平地步行时速度大概保持在6.4 km/h
短距离跑步
扫地或搬重家具
打高尔夫球或网球双打。
>10 METs
游泳
网球单打
篮球
滑雪。
出现以下一种或多种心脏疾病者被认为属于高风险患者,须进行强化管理,并且可能导致手术延期或取消(紧急外科手术除外)。[4]
不稳定型冠状动脉综合征
不稳定型或严重心绞痛
近期心肌梗死
失代偿性心力衰竭
明显心律失常
莫氏Ⅱ型房室传导阻滞
Ⅲ度房室传导阻滞
有症状的室性心律失常
室上性心律失常(包括心房颤动)伴心室率未控制(静息状态心率>100 bpm)
有症状的心动过缓
新近出现的室性心动过速
重度心脏瓣膜病
重度主动脉瓣狭窄(平均跨瓣压差>40 mmHg、主动脉瓣面积<1.0 cm^2或有症状)
有症状的二尖瓣狭窄(进展性劳力性呼吸困难、劳力性晕厥或心力衰竭)
没有发现上述心脏疾病但存在以下一个或多个临床危险因素者,属于中等风险患者:[4]
心脏病病史
代偿性心力衰竭病史或者既往心力衰竭
脑血管疾病病史
糖尿病
肾功能不全。
没有发现上述心脏疾病和临床风险因素者,属于低风险患者。[4]
可使用诊断性检查来改善风险评估。其中一些诊断性检查使得能够根据检查结果进行风险分层(例如负荷试验)。
改良心脏风险指数 (revised cardiac risk index, RCRI):
改良心脏风险指数使用 6 个变量来预测围手术期心血管风险 [8]:
高风险外科手术(开胸手术、开腹手术或腹股沟以上血管手术)
缺血性心脏病(定义如下:具有 MI 病史、心电图显示病理性 Q 波、使用硝酸盐类药物、运动负荷试验结果异常或存在继发于缺血性因素的胸痛)
存在充血性心力衰竭
脑血管病史
需使用胰岛素治疗的糖尿病
术前血清肌酐水平高于 2 mg/dL。
以上 6 个风险变量各占 1 分。具有 0、1 或 2 个风险因素者分别属于 RCRI I 级、II 级和 III 级患者。具有 3 个或更多风险因素者属于 RCRI IV 级,为高风险患者。各级别对应的重大心脏事件发生风险分别为 0.4%(I 级)、0.9%(II 级)、6.6%(III 级)和 11%(IV 级)。总体而言,RCRI 能针对所有类型的非心脏手术对低风险和高风险患者进行有效分层,但对于接受血管外科手术的患者,准确度较低。
新英格兰血管研究组心脏风险指数 (Vascular Study Group of New England cardiac risk index, VSG-CRI):
VSG-CRIVSGNE 风险指数是针对接受血管外科手术的患者开发的,适用于颈动脉内膜切除术、下肢旁路手术以及未破裂型腹主动脉瘤开放与腔内修复术。 [9]不良心脏事件(MI、心律失常和心力衰竭,不包括死亡)的独立预测因素为:年龄增加、吸烟、胰岛素依赖型糖尿病、冠状动脉疾病、冠状动脉性心力衰竭、心脏运动负荷试验异常、长期使用 β 受体阻滞剂、慢性阻塞性肺病以及肌酐 ≥160 μmol/L (≥1.8 mg/dL)。既往行血运重建术为保护性因素。随着评分的增加,VSG-CRI 预测的心脏事件风险水平逐渐升高,从最低风险评分 (0-3) 时的 2.6% 升高至最高风险评分 (7-8) 时的 14.3%。对于接受血管外科手术的患者,该风险指数比 RCRI 准确。 [9]
高危手术
急诊大型手术,尤其是在高龄(>70岁)患者中
主动脉或周围血管疾病
失血量较大的大型手术。
中危手术
腹腔内或胸腔内手术
颈动脉内膜切除术
头颈部手术
骨科手术
前列腺手术。
低危手术
内镜手术
浅表活检
白内障手术
乳腺手术。
一般可通过病史和体格检查来识别有围手术期不良心脏事件风险的患者。低风险患者在非心脏外科手术前一般不需要额外的检查。不过,拟接受择期手术的中等风险和高风险患者可能需要一些额外的检查。
1. 术前静息状态 12 导联 ECG
对于即将接受低危手术的无症状患者,不需要进行该检查
推荐以下患者接受该检查:
有至少一个临床危险因素,并且准备接受血管外科手术(临床危险因素包括缺血性心脏病病史、代偿性或既往心力衰竭、脑血管疾病、糖尿病、肾功能不全)的患者
已知有冠心病、周围动脉疾病或脑血管病且拟行中等风险手术的患者。[4]
2. 术前应用超声心动图或核素扫描对左心室功能进行无创性评估
以下患者接受该检查较为合理,或者推荐以下患者使用:
不明原因的呼吸困难
目前或既往发生心力衰竭,并伴有进行性加重的呼吸困难或临床状况的其他改变,并且既往12个月内未进行左心室功能评估。
不推荐围手术期对左心室功能进行常规评估。
3. 运动负荷试验
有助于发现心肌缺血和评估心脏功能储备
通常需要进一步评估的活动性心脏疾病(例如不稳定型心绞痛、失代偿性心力衰竭或重度瓣膜性心脏病)患者适合接受该检查
对于存在 3 个或更多个心脏风险临床预测因素、功能储备差(<4 个代谢当量 [MET])且拟行血管手术的患者,如果该试验结果可能改变患者的管理策略,则进行该试验是合理的
对接受低危非心脏外科手术的患者用处不大。
4. 冠状动脉造影
5. 脑钠肽 (brain natriuretic peptide, BNP)
1. 运动 ECG
需要预估心脏功能储备,探查心肌缺血并评估负荷时的血流动力学表现。当患者适合进行无创性检查并且可以行走时,运动ECG是最好的选择。
根据运动ECG进行围手术期风险分层:
低风险:能够进行中等强度的运动(4-5 METs)且无症状;患者心率超过最大预测心率的75%时ECG无异常改变
中等风险:当心率超过最大预测心率的75%时,ECG有异常表现
高风险:当心率低于最大预测心率的75%时,ECG即出现异常表现。
2. 负荷显像
适用于存在基线 ECG 异常(例如左心室肥大 [left ventricular hypertrophy, LVH]、洋地黄效应、左束支传导阻滞)的患者。药物灌注成像适用于拟接受骨科、神经外科或血管外科手术,并且无法运动、有左束支传导阻滞或已植入起搏器的患者。
对于接受茶碱类药物治疗的患者以及有重度阻塞性肺病或极重度颈动脉狭窄的患者,禁忌使用双嘧达莫。
多巴酚丁胺负荷超声心动图与双嘧达莫铊试验作为术前评估工具的效果相当,但前者不能用于重度高血压、严重心律失常或超声心动图图像质量较差的患者。
根据负荷影像学进行围手术期风险分层:
超过 4 个心肌节段出现再分布显像提示有显著围手术期不良事件发生风险。
3 个冠状动脉灌注区域的再分布显像和可逆性左心室腔扩大提示不良事件发生风险更高。
在特定部位,缺血的总面积比缺血的严重程度更有预测价值。
美国外科医师学会全国手术质量改进计划 (American College of Surgeons National Surgical Quality Improvement Program, ACS NSQIP) 开发了一款使用 21 项术前因素的手术风险计算器。[13] 具体的因素包括 20 种患者特征(年龄、性别、功能分类、急诊病例、美国麻醉师学会 [American Society of Anaesthesiologists, ASA] 分类、皮质类固醇使用、30 天内出现腹水、全身性脓毒症、依赖通气装置、出现癌症扩散、糖尿病、高血压、30 天内心力衰竭、出现呼吸困难、目前的吸烟状态、重度 COPD 病史、需要透析、存在急性肾衰竭、身高和体重)和手术类型。该模型能够良好地预测死亡率(C 统计量 = 0.944;Brier 评分 = 0.011 [评分接近 0 较好])、发病率(C 统计量 = 0.816;Brier 评分 = 0.069)和另外 6 种并发症(C 统计量 >0.8)。[13] ACS NSQIP 手术风险计算器能使外科医生针对不同患者快捷地估算其重大的术后风险,并以便于患者理解的形式显示信息。
围手术期治疗包括:
术前通过冠状动脉旁路移植术或经皮冠状动脉介入术进行血运重建
β 受体阻滞剂
他汀类药物
α2 受体激动剂。
非心脏外科手术前进行血管造影和血运重建[4]
适用于存在明显左主干狭窄的稳定性心绞痛、冠状动脉三支病变(当左室射血分数<0.5时生存获益更大)、双支病变伴左前降支近端显著狭窄(且伴射血分数<0.5或无创性检查评估发现明显缺血)的患者
推荐用于不稳定型心绞痛、非 ST 段抬高心肌梗死或急性 ST 段抬高型心肌梗死的患者
不推荐常规用于稳定型冠状动脉病 (CAD) 患者。数项随机试验的结果显示,对于稳定型 CAD 患者,在择期大型血管外科手术前进行冠状动脉血运重建不能改善远期结局。而且,在最佳化药物疗法的基础上进行术前经皮冠状动脉介入术并没有降低死亡、MI 或其他重大心血管不良事件的风险。[7][10]
大多数经皮冠状动脉血运重建会使用冠状动脉支架。对于这类患者,将非心脏外科手术延期可能有益。不推荐在冠状动脉金属裸支架植入后 4-6 周内或者药物洗脱支架植入后 6-12 个月内进行择期非心脏外科手术;同样,对于围手术期需停止 P2Y12 抑制剂治疗(例如氯吡格雷、普拉格雷、替格瑞洛)或阿司匹林联合噻吩吡啶类药物治疗的患者,也不推荐行该类择期手术。[4] 在支架植入术后最初 6 个月内,非心脏外科手术导致支架植入术后患者发生不良心脏事件的增量风险最高,在 6 个月后稳定在 1.0%。对于植入药物洗脱支架 (drug-eluting stent, DES) 的患者,支架植入后间隔 6 个月行择期、高风险、住院手术的获益最大。[14]
对于拟行非心脏外科手术者,在围手术期使用 β 受体阻滞剂可能有助于降低已知 CAD 患者的缺血发生率、MI 风险以及死亡率。[4][15]
β 受体阻滞剂治疗
对于因心绞痛、有症状的心律失常、高血压或其他美国心脏病学会/美国心脏协会(ACC/AHA)指南规定的Ⅰ类适应证而接受治疗的患者,应继续应用。
如果术前风险分层评估显示患者具有中度或高度心肌缺血风险,启动围手术期 β 受体阻滞剂治疗是合理选择。
对于即将接受非心脏外科手术且未使用 β 受体阻滞剂的患者,在未逐渐增加剂量的情况下常规给予大剂量 β 受体阻滞剂没有帮助,并且可能是有害的。
对于已启动 β 受体阻滞剂治疗的患者,提前足够时间启动围手术期 β 受体阻滞剂治疗是合理的,以评估安全性和耐受性,最好是在术前 2 天或更早(不超过 30 天)启动。不应在手术当天启动 β 受体阻滞剂治疗。
初始治疗可选用美托洛尔 25 mg,口服,每日两次,然后逐渐加量,直至维持心率 <60 次/分,也可选用比索洛尔 5-10 mg,口服,每日一次。药物治疗需在择期手术前 2-30 日开始,持续到术后 48 小时至 7 天。一项随机对照研究结果显示,与安慰剂组相比,围手术期使用美托洛尔缓释剂能够降低随机化后 30 天时 MI、心脏血运重建和具有临床意义的心房颤动的风险。然而,也有证据显示,在罹患动脉粥样硬化疾病或具有该病患病风险的患者中,使用 β 受体阻滞剂可能会导致死亡、卒中以及具有临床意义的低血压和心动过缓的风险明显过高。因此,对常规使用 β 受体阻滞剂应保持谨慎。[15][16]
现有证据表明,非心脏外科手术围手术期使用他汀类药物对心脏并发症有保护作用。他汀类治疗可使非心脏外科手术后的死亡率降低 44%。[17]
对于正在接受他汀类药物治疗且拟接受非心脏外科手术的患者,应当继续进行治疗。
无论是否存在心脏风险,对于拟接受血管外科手术的患者,应用他汀类药物进行治疗是合理的。对于接受紧急或急诊大型血管外科手术且没有使用他汀类药物治疗的患者,如果有可能,应在术前启动他汀类药物治疗。
针对围手术期心肌缺血
术中和术后监测心电图ST段的变化对已知CAD患者或接受血管外科手术的患者有帮助。
针对围手术期心肌梗死
对于出现 ECG 改变或者有急性冠脉综合征典型胸痛的患者,推荐进行术后肌钙蛋白检测。[4]
有症状的主动脉瓣狭窄
重度主动脉瓣狭窄是非心脏外科手术的显著风险。指南建议,通常应推迟或取消此类患者的择期非心脏外科手术。[4]
患者在接受必要的择期非心脏外科手术前,应先接受主动脉瓣置换术。
无症状的主动脉瓣狭窄
如果主动脉瓣狭窄程度为重度但无症状,并且过去一年内未进行瓣膜状态评估,则应推迟或取消手术。
对于拒绝接受心脏外科手术的患者或者不适合接受主动脉瓣置换术的患者,行非心脏外科手术的死亡风险约为 10%。如果患者不适合接受瓣膜置换术,经皮主动脉瓣球囊成形术作为手术前的合理过渡方案用于以下情况可能合理:存在血流动力学不稳定的主动脉狭窄成人患者,并且其接受主动脉瓣置换术的风险高;因严重伴发疾病无法接受主动脉瓣置换术的主动脉狭窄成人患者。经皮瓣膜置换术也是一种可供选用的治疗手段。
接受精神类药物治疗的患者[20]
不应在麻醉前停止慢性抑郁症患者长期使用的抗抑郁药物治疗。
长期接受三环类抗抑郁药物治疗的患者需要在麻醉前接受心脏评估。
不可逆性单胺氧化酶抑制剂需要在麻醉前至少停药两周。为了避免基础疾病复发,可将药物更换为可逆性单胺氧化酶抑制剂。
对于精神分裂症患者,如果术前暂停药物治疗,术后精神错乱的发生率明显更高。因此,慢性精神分裂症患者在围手术期应该继续使用抗精神病药。
应该在术前72小时停用锂剂。如果患者血电解质正常、血流动力学稳定、可以正常进食饮水,可在术后恢复用药。
老年外科患者的术前评估[21]
来自美国全国医院出院调查 (US National Hospital Discharge Survey) 的数据显示,高龄患者的住院率增加。[22][23] 为了满足改善老年患者外科治疗质量的需求,美国外科医师协会全国性外科质量改进计划 (American College of Surgeons National Surgical Quality Improvement Program) 和美国老年病学会 (American Geriatrics Society) 制定了实践指南,以保证老年外科患者在围手术期得到最恰当的治疗。[21] 指南制定小组优先解决了针对高龄患者的一系列术前情况(例如认知障碍、身体虚弱、多药治疗等)以及这类患者中其他一些常见问题(例如营养不良的风险、缺少家人和社会支持等)。用于改善老年外科患者术前评估的专家共识声明和循证推荐汇总于列表中:[21]
充分了解病史以及进行全面的体格检查
评估认知能力和对即将接受手术的了解情况
筛查是否存在抑郁
识别并记录发生术后谵妄的危险因素
筛查酒精及其他物质滥用/依赖
根据当地指导对拟行非心脏外科手术的患者进行术前心脏评估(例如美国心脏病学会/美国心脏协会、[4] 欧洲心脏病学学会/欧洲麻醉学会[3])
识别术后肺部并发症的危险因素,并开展预防工作
记录功能状态和跌倒史
确定基线虚弱状态评分
评估营养状态,如果患者有重度营养不良风险,需考虑在术前进行干预
记录用药史,考虑围手术期进行适当的调整。监测多药联用情况
确定患者的治疗目标和预期是否处于可能治疗结局的范围内
确定患者的家庭和社会支持系统
为高龄患者安排适当的术前诊断性检查。
(改编自:Chow WB,RosenthalRA,Merkow RP,et al.Optimal preoperative assessment of the geriatric surgical patient:a best practices guideline from the American College of Surgeons National Surgical Quality Improvement Program and the American Geriatrics Society.J Am Coll Surg.2012;215:453-466.[21])
非心脏外科手术的紧急程度[4]
确定进行非心脏外科手术的紧急性非常重要。在很多情况下,患者或外科手术相关因素决定了必须立即进行手术,可能不允许进行进一步的心脏评估和治疗。在这些情况下,进行围手术期药物管理、监测和术后风险分层是恰当的。
无需进行心脏检查[4]
过去5年内接受过冠状动脉旁路移植手术、6个月至5年内接受经皮冠状动脉介入术而且没有心肌缺血临床证据的患者,因外科手术而发生心脏并发症的风险较低。他们术前无需接受进一步检查,特别是功能状态良好且无症状的患者。
曾于过去 2 年内接受过有创或无创检查且结果良好的患者,如果检查后无症状出现且功能状态良好,一般来说不需要再接受进一步心脏诊断性检查。
无创性心脏检查[4]
无创检查结果可用于确定下一步措施,包括强化药物治疗或者决定直接行外科手术或心导管插入术。心导管检查可能导致进行冠状动脉血运重建,尤其适用于该项治疗可能改善患者长期预后时(例如在左主干狭窄或三支病变伴左心室功能受损的患者中)。
具有心脏风险中等预测因素的患者,如果存在功能储备差或者功能储备中等但是外科手术高风险,可能意味着患者能从进一步的无创心脏检查中获益。
对于功能储备良好且无症状的患者,极少因为任何进一步的心血管检查结果而改变管理方法。因此,可以直接进行计划的手术。功能状态评估是指南的一个重要方面。
根据心脏风险的临床预测因素、功能储备和外科手术类型来确定非心脏外科手术的风险[4]
没有或仅有很少的心脏风险临床预测因素且功能储备良好或中等的患者可安全地接受非心脏外科手术。
有中等心脏风险临床预测因素且功能储备良好或中等的患者一般能够接受低风险和中等风险的手术,且不良事件发生率较低。
存在不稳定型冠状动脉综合征、失代偿性心力衰竭、有症状的心律失常或严重瓣膜性心脏病的患者,如果拟接受择期非心脏外科手术,应取消或推迟手术,直至心脏问题明确诊断并得到治疗。
手术类型本身也可能有助于识别有较大可能性患有潜在心脏疾病且围手术期并发症发生率和死亡率较高的患者。研究比较深入的是血管外科手术,在这类手术患者中,有相当一部分存在潜在的冠状动脉和脑血管疾病。研究结果表明,如果这类患者接受血管外科手术,仅需在检查会改变管理方法的情况下考虑实施检查。其他类型的手术可能存在与血管外科手术相似的风险,但并没有获得深入研究。
不建议在非心脏外科手术前常规进行冠状动脉血运重建术,以减少围手术期心脏事件。
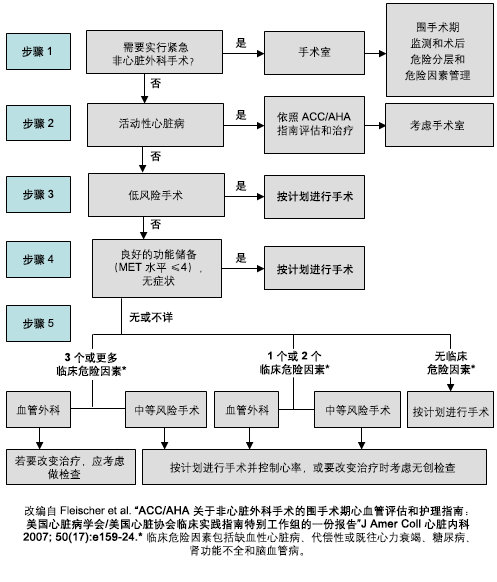 [Figure caption and citation for the preceding image starts]: 非心脏外科手术的心脏评估和治疗方案改编自 Fleisher LA, et al.J Am Coll Cardiol.2014;64:e77-e137 [Citation ends].
[Figure caption and citation for the preceding image starts]: 非心脏外科手术的心脏评估和治疗方案改编自 Fleisher LA, et al.J Am Coll Cardiol.2014;64:e77-e137 [Citation ends].
步骤 1. 对外科手术的紧急程度进行评估。紧急情况下,患者或手术相关因素决定了处理策略,无法行进一步的心脏检查和治疗。在这些情况下,主任医师提供围手术期药物治疗、心脏事件监测和继续接受心血管药物长期治疗的建议。[3]
步骤 2. 如果患者处于不稳定状态,则需要在手术前明确潜在的病因,并进行恰当的治疗。此类情况包括不稳定性冠状动脉综合征、失代偿性心力衰竭、严重心律失常或有症状的瓣膜病。此时可能需要取消或推迟手术。例如,不稳定型心绞痛患者需要转诊进行冠状动脉造影,以评估治疗选择。治疗决策需由多学科治疗团队讨论决定,以确定对麻醉和外科治疗的影响。例如,冠状动脉支架植入术后启动双联抗血小板药物治疗可能使局部或区域麻醉或者特定类型的外科手术变得更加复杂。如果手术能够推迟,患者就可以接受冠状动脉干预(包括冠状动脉旁路移植术、球囊成形术或支架植入术),并开始接受双联抗血小板治疗。如果推迟手术与最佳化药物治疗相冲突,则患者应及时接受手术。[3]
步骤 3. 对于心脏状态稳定的患者,临床医生需确定外科手术的风险。对于心脏状态稳定的患者,如果预计术后 30 天的心脏风险较低 (<1%),心脏检查的结果不大可能改变管理策略,则按计划进行外科手术可能是恰当的。主任医师可确定危险因素,并提供针对生活方式和药物疗法的建议,以改善患者的远期结局。对于已知罹患缺血性心脏病 (ischaemic heart disease, IHD) 或心肌缺血的患者,可考虑在外科手术前启动 β 受体阻滞剂疗法。最好在术前 30 天至术前至少 2 天的时间范围内启动治疗,并且应在术后继续用药。β 受体阻滞剂用药应从低剂量开始,然后逐渐增加,直至静息心率维持在 60-70 次/分且收缩压 >100 mmHg。对于心力衰竭和左室收缩功能不全(指征为 LVEF<40%)的患者,应考虑术前使用血管紧张素转换酶抑制剂 (angiotensin-converting enzyme inhibitor, ACEI),如果患者不耐受 ACEI,则应考虑使用血管紧张素受体阻滞剂 (angiotensin-receptor blocker, ARB)。对于拟行血管外科手术的患者,应考虑启动他汀类药物治疗。仅在术中出血难以控制的患者中,考虑停用阿司匹林。[3]
步骤 4. 评估患者的功能储备。如果患者无症状或心脏状态稳定,并且功能储备中等或良好(即 >4 个代谢当量 [MET]),则无论将接受什么手术,都不太可能会根据检查结果调整围手术期治疗策略。即使患者存在某些临床危险因素,将患者转诊进行手术也可能是恰当的。对于存在缺血性心脏病 (IHD) 或相关危险因素的患者,可在术前启动他汀类药物治疗和 β 受体阻滞剂小剂量逐渐递增治疗方案。[3]
步骤 5. 对于功能储备中等或较差的患者,需考虑外科手术的风险。计划接受中等风险外科手术的患者可按时进行手术。除了上述建议,对于存在一个或多个临床危险因素的患者,推荐进行术前基线 ECG 检查,以便监测术中 ECG 变化。[3]
步骤 6. 对于计划接受高风险外科手术的患者,如果其临床危险因素超过 2 个,则考虑进行无创性检查。识别危险因素,并最大程度优化药物治疗。[3]
步骤 7. 无创性运动负荷试验结果判读:对于没有劳力性心肌缺血或缺血程度为轻度至中度(仅 1-2 支血管受累)的患者,可以按计划进行外科手术。如果无创性检查发现患者有严重的劳力性心肌缺血,则应权衡计划手术的可能获益与不良结局的预测风险,从而制定个体化的围手术期管理策略。此外,还必须评估药物治疗和/或冠状动脉重建术在改善术后早期和远期结局方面的效果。[3]
关于冠状动脉血运重建术后外科手术时机的推荐如下:[3]
对于近期接受过球囊成形术的患者,外科医师应考虑推迟非心脏外科手术,直至干预治疗后至少 2 周
对于近期植入过金属裸支架的患者,如果需接受非紧急、非心脏外科手术,应考虑至少间隔 4 周,最好是在该介入手术后 3 个月进行
对于近期植入过药物洗脱支架 (DES) 的患者,如果需接受非紧急、非心脏外科手术,应考虑在该介入手术后至少 12 个月进行。如果是新一代 DES,该间隔时间可缩短至 6 个月。
使用此内容应接受我们的免责声明。
