心肌病的分型可参照AHA工作组的建议。[1]Maron BJ, Towbin JA, Thiene G, et al. Contemporary definitions and classification of the cardiomyopathies: an American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention. Circulation. 2006;113:1807-1816.http://circ.ahajournals.org/content/113/14/1807.full.pdf+htmlhttp://www.ncbi.nlm.nih.gov/pubmed/16567565?tool=bestpractice.com
原发性心肌病:遗传性
肥厚型心肌病  [Figure caption and citation for the preceding image starts]: 心尖肥厚型心肌病:心脏超声心动的增强性四腔心切面图Ahmed I, Smalley SJ, Zhu DWX, et al. Sudden cardiac arrest in apical hypertrophic cardiomyopathy. BMJ 病例报告。 2009;doi:10.1136/bcr.04.2009.17 [Citation ends].
[Figure caption and citation for the preceding image starts]: 心尖肥厚型心肌病:心脏超声心动的增强性四腔心切面图Ahmed I, Smalley SJ, Zhu DWX, et al. Sudden cardiac arrest in apical hypertrophic cardiomyopathy. BMJ 病例报告。 2009;doi:10.1136/bcr.04.2009.17 [Citation ends].
一种相对常见的疾病,在一般人群中的发病率约为 1/500,其特征为在无其他诱发疾病(例如主动脉瓣狭窄或高血压)的情况下出现左心室非扩张性肥厚。心肌肥厚的发生通常与年龄相关。早期研究提示,心肌肥厚一般发生在青春期,现在越来越多地发现较晚发生的疾病。鉴于此,根据现行指南,应为临床未受影响的青少年和成年家属提供筛查。[4]Gersh BJ, Maron BJ, Bonow RO, et al; American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines; American Association for Thoracic Surgery; American Society of Echocardiography; American Society of Nuclear Cardiology; Heart Failure Society of America; Heart Rhythm Society; Society for Cardiovascular Angiography and Interventions; Society of Thoracic Surgeons. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2011;124:e783-e831.http://circ.ahajournals.org/content/124/24/e783.full.pdfhttp://www.ncbi.nlm.nih.gov/pubmed/22068434?tool=bestpractice.com[5]Elliott PM, Anastasakis A, Borger MA, et al; Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). 2014 ESC guidelines on diagnosis and management of hypertrophic cardiomyopathy. Eur Heart J. 2014;35:2733-2779.http://eurheartj.oxfordjournals.org/content/35/39/2733.longhttp://www.ncbi.nlm.nih.gov/pubmed/25173338?tool=bestpractice.com 欧洲心脏病学会 (European Society of Cardiology, ESC) 指南为医疗保健专业人员提供了针对各年龄患者的实用诊断和治疗框架。[5]Elliott PM, Anastasakis A, Borger MA, et al; Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). 2014 ESC guidelines on diagnosis and management of hypertrophic cardiomyopathy. Eur Heart J. 2014;35:2733-2779.http://eurheartj.oxfordjournals.org/content/35/39/2733.longhttp://www.ncbi.nlm.nih.gov/pubmed/25173338?tool=bestpractice.com 这些指南还考虑到诊断对家庭可能产生的影响。
肥厚型心肌病一般为非对称性的,需要指出的是肥厚可以发生在心脏的任何部位。 常伴有舒张功能失常。 高达1/3的患者存在左心室流出道梗阻,而其他患者可能存在因运动或其他血流动力学负荷增加而诱发的流出道压力阶差。
心房颤动常见,伴心房颤动者血栓栓塞风险高, 高达10%的患者进展为终末期收缩功能失常,左心室通常无明显扩张。
诊断通常应结合心电图和心脏MRI结果,最常见的是应用超声心动图。[6]Nagueh SF, Bierig SM, Budoff MJ, et al; American Society of Echocardiography; American Society of Nuclear Cardiology; Society for Cardiovascular Magnetic Resonance; Society of Cardiovascular Computed Tomography. American Society of Echocardiography clinical recommendations for multimodality cardiovascular imaging of patients with hypertrophic cardiomyopathy: endorsed by the American Society of Nuclear Cardiology, Society for Cardiovascular Magnetic Resonance, and Society of Cardiovascular Computed Tomography. J Am Soc Echocardiogr. 2011;24:473-498.http://www.onlinejase.com/article/S0894-7317(11)00189-1/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/21514501?tool=bestpractice.com 已确诊的患者需要进一步检查(如动态心电图监测、运动负荷试验)。[7]Guazzi M, Adams V, Conraads V, et al. EACPR/AHA Scientific Statement. Clinical recommendations for cardiopulmonary exercise testing data assessment in specific patient populations. Circulation. 2012;126:2261-2674.http://circ.ahajournals.org/content/126/18/2261.longhttp://www.ncbi.nlm.nih.gov/pubmed/22952317?tool=bestpractice.com 这些检查应作为风险分层的一部分进行,针对风险分层,已经提出以下多种危险因素:既往发生心搏骤停或持续性室性心动过速、非持续性室性心动过速、左心室极度肥厚(>30 mm)、难以解释的晕厥、对运动的异常血压反应、猝死家族史、严重的左心室流出道梗阻等。[8]Christiaans I, van Engelen K, van Langen IM, et al. Risk stratification for sudden cardiac death in hypertrophic cardiomyopathy: systematic review of clinical risk markers. Europace. 2010;12:313-321.http://www.ncbi.nlm.nih.gov/pubmed/20118111?tool=bestpractice.com[9]Garratt CJ, Elliott P, Behr E, et al. Heart Rhythm UK position statement on clinical indications for implantable cardioverter defibrillators in adult patients with familial sudden cardiac death syndromes. Europace. 2010;12:1156-1175.http://europace.oxfordjournals.org/content/12/8/1156.longhttp://www.ncbi.nlm.nih.gov/pubmed/20663787?tool=bestpractice.com[10]O'Mahony C, Tome-Esteban M, Lambiase PD, et al. A validation study of the 2003 American College of Cardiology/European Society of Cardiology and 2011 American College of Cardiology Foundation/American Heart Association risk stratification and treatment algorithms for sudden cardiac death in patients with hypertrophic cardiomyopathy. Heart. 2013;99:534-541.http://www.ncbi.nlm.nih.gov/pubmed/23339826?tool=bestpractice.com[11]McKeown PP, Muir AR. Risk assessment in hypertrophic cardiomyopathy: contemporary guidelines hampered by insufficient evidence. Heart. 2013;99:511-513.http://heart.bmj.com/content/99/8/511.longhttp://www.ncbi.nlm.nih.gov/pubmed/23376948?tool=bestpractice.com 心脏磁共振成像(MRI)的应用在增加,心脏MRI可以准确地评估心室肥厚程度,通过钆延迟增强显像还可以检测心肌纤维化。[12]Aquaro GD, Masci P, Formisano F, et al. Usefulness of delayed enhancement by magnetic resonance imaging in hypertrophic cardiomyopathy as a marker of disease and its severity. Am J Cardiol. 2010;105:392-397.http://www.ncbi.nlm.nih.gov/pubmed/20102955?tool=bestpractice.com 研究表明,钆延迟显像增强范围与心脏性猝死风险增加相关但并不是独立的预测因子。钆延迟显像增强与非持续性室性心动过速增高相关。[13]O'Hanlon R, Grasso A, Roughton M, et al. Prognostic significance of myocardial fibrosis in hypertrophic cardiomyopathy. J Am Coll Cardiol. 2010;56:867-874.http://www.ncbi.nlm.nih.gov/pubmed/20688032?tool=bestpractice.com 美国研究人员观察到,钆延迟可能使得能够更好地选择需使用除颤器进行一级预防的患者。[14]Maron BJ, Maron MS. LGE means better selection of HCM patients for primary prevention implantable defibrillators. JACC Cardiovasc Imaging. 2016 Jul 14 [Epub ahead of print].http://www.ncbi.nlm.nih.gov/pubmed/27450875?tool=bestpractice.com 一种被称为肥厚性心肌病心源性猝死风险 (HCM Risk-SCD) 的 ESC 风险预测模型已得到开发和验证,用以提供个体化的心源性猝死 5 年风险评估,[15]O'Mahony C, Jichi F, Pavlou M, et al; Hypertrophic Cardiomyopathy Outcomes Investigators. A novel clinical risk prediction model for sudden cardiac death in hypertrophic cardiomyopathy (HCM risk-SCD). Eur Heart J. 2014;35:2010-2020.http://eurheartj.oxfordjournals.org/content/35/30/2010.longhttp://www.ncbi.nlm.nih.gov/pubmed/24126876?tool=bestpractice.comESC: HCM Risk-SCD 但其不包括心脏 MRI 扫描的钆对比剂延迟强化。在 40 岁以上或有其他心血管危险因素的患者中,为了排除伴随的冠状动脉疾病,可能需要进行冠状动脉造影检查,特别是对于因非典型心绞痛或呼吸困难症状而就诊的患者。尽管心肌细胞紊乱是肥厚型心肌病的标志性病理变化,但由于心肌细胞紊乱经常呈片状分别,且正常个体可能有心肌细胞紊乱,所以心内膜活检很少应用。
基因检测在这次讨论的范畴之外。但是,传统的肥厚型心肌病被认为是一种肌节疾病,已发现很多与肌节相关的基因变异与肥厚型心肌病相关,如编码肌球球蛋白重链、肌球蛋白结合蛋白C、心肌肌钙蛋白T、心肌肌钙蛋白I、肌动蛋白的基因。 而由其他非编码肌节蛋白的基因包括PRKAG2(常与预激有关)和少见的LAMP-2基因(Danon病)。[16]Bos JM, Towbin JA, Ackerman MJ. Diagnostic, prognostic, and therapeutic implications of genetic testing for hypertrophic cardiomyopathy. J Am Coll Cardiol. 2009;54:201-211.http://www.ncbi.nlm.nih.gov/pubmed/19589432?tool=bestpractice.com 很多其他疾病可能表现肥厚型心肌病表型,认识到这一点很重要。此类疾病包括一系列综合征性疾病,例如 Fabry 综合征(特别是在 35 岁以后出现向心性肥厚的男性中)、[17]Hoffmann B. Fabry disease: recent advances in pathology, diagnosis, treatment and monitoring. Orphanet J Rare Dis. 2009;4:21.http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2768700/?tool=pubmedhttp://www.ncbi.nlm.nih.gov/pubmed/19818152?tool=bestpractice.com Noonan 综合征/Leopard 综合征[18]Sarkozy A, Digilio MC, Dallapiccola B. Leopard syndrome. Orphanet J Rare Dis. 2008;3:13.http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2467408/?tool=pubmedhttp://www.ncbi.nlm.nih.gov/pubmed/18505544?tool=bestpractice.com 和 Friedreich 共济失调,[19]Schulz JB, Boesch S, Bürk K, et al. Diagnosis and treatment of Friedreich ataxia: a European perspective. Nat Rev Neurol. 2009;5:222-234.http://www.ncbi.nlm.nih.gov/pubmed/19347027?tool=bestpractice.com 还有多种其他代谢疾病、线粒体疾病、糖原贮积病。诊断这些疾病需要很高的警惕性,并使用恰当的诊断工具。[20]Towbin JA. Hypertrophic Cardiomyopathy. Pacing Clin Electrophysiol. 2009;32(Suppl 2):S23-S31.http://www.ncbi.nlm.nih.gov/pubmed/19602159?tool=bestpractice.com 在年轻的健康群体中特别需要鉴别的是“运动员心脏”。 很多因素可以用来鉴别肥厚型心肌病和运动员心脏,如:肥厚的程度、左心室直径、左心房扩大程度、是否存在左心室流出道梗阻、多普勒参数变化、峰值氧消耗量、脑钠肽前提水平、停止运动后室壁厚度回缩等情况以及基因检测等。[21]Cheng TO. Hypertrophic cardiomyopathy vs athlete's heart. Int J Cardiol. 2009;131:151-155.http://www.ncbi.nlm.nih.gov/pubmed/19028403?tool=bestpractice.com
致心律失常右心室心肌病/发育不良(ARVC/D)
以纤维-脂肪组织进行性取代正常心肌组织为特征, 这些改变最常见于三角区(右心室流入道、流出道和心尖),但是左心室中发现此改变的病例也在增加。 常染色体显性遗传是最常见的表现形式,尽管常染色体变异(如Naxos病和Carvajal综合征,常伴头发、皮肤改变)也可见到。 ARVC代表了一大类疾病,包括心脏电活动和运动功能异常。 心电图改变从最常见的心律失常到致命的室性心动过速不等。 心肌收缩功能异常从轻微的收缩功能失常到严重的左心室和右心室衰竭不等。[22]Basso C, Corrado D, Marcus FI, et al. Arrhythmogenic right ventricular cardiomyopathy. Lancet. 2009;373:1289-1300.http://www.ncbi.nlm.nih.gov/pubmed/19362677?tool=bestpractice.com 患者的表现从心律失常、心力衰竭到猝死不等。 在意大利Veneto区,AVRC是青少年心脏性猝死最常见的原因。 行右心室影像检查较困难。 诊断较困难,需要联合多种方法,如超声/磁共振/血管造影图像、动态心电图监测、通过负荷试验发现心律失常、静息心电图异常(T波异常、右心室传导阻滞、epsilon波)、心室晚电位、心内膜或尸体活检组织学改变等。
很多基因与之相关,最常见的是桥粒基因,虽然RYR2和TGF-β基因变异所致也有报告。 ARVC 工作组诊断标准发表于 1994 年。[23]McKenna WJ, Thiene G, Nava A, et al. Diagnosis of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Br Heart J. 1994;71:215-218.http://www.ncbi.nlm.nih.gov/pmc/articles/PMC483655/pdf/brheartj00172-0007.pdfhttp://www.ncbi.nlm.nih.gov/pubmed/8142187?tool=bestpractice.com 然而,使用这些者诊断标准对其他家庭成员而言较宽松,所以诊断标准在不断修订中。[24]Hamid MS, Norman M, Quraishi A, et al. Prospective evaluation of relatives for familial arrhythmogenic right ventricular cardiomyopathy/dysplasia reveals a need to broaden diagnostic criteria. J Am Coll Cardiol. 2002:40:1445-1450.http://www.ncbi.nlm.nih.gov/pubmed/12392835?tool=bestpractice.com 新近进一步修订后的标准已经在讨论中,包括用MRI评估心脏结构,并给出了更多与ARVC相关的右心室大小及心脏功能指标。[25]Marcus FI, McKenna WJ, Sherrill D, et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: proposed modification of the task force criteria. Circulation. 2010;121:1533-1541.http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2860804/http://www.ncbi.nlm.nih.gov/pubmed/20172911?tool=bestpractice.com 尽管通常被分为4期,但自然病史资料有限。[26]Corrado D, Basso C, Thiene G. Arrhythmogenic right ventricular cardiomyopathy: diagnosis, prognosis, and treatment. Heart. 2000;83:588-595.http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1760807/pdf/v083p00588.pdfhttp://www.ncbi.nlm.nih.gov/pubmed/10768917?tool=bestpractice.com
潜伏期:即早期,通常为无症状阶段,尽管也可表现为猝死。
明显的心律失常期:有心律失常症状的不稳定时期,常为左束支传导阻滞,提示来源于右心室。
右心室衰竭期:右心室收缩功能进行性下降的时期。
双心室泵衰竭期:双侧心室进行性扩张期,与扩张型心肌病表现类似。
左心室致密化不全
官方首次描述左心室致密化不全是在1990年,其特点是存在海绵状心肌,认为是正常的胚胎停止发育的结果(心脏致密化起始于妊娠后第5至8周,左心室致密化较右心室更明显)。 致密化不全主要涉及左心室心尖部(双心室致密化不全的也有报道但较少见)。 它可以是一个孤立的疾病,或与其他先天性心脏病(如室间隔缺损、Ebstein畸形、二叶主动脉瓣、α-dystrobrevin/NKX2.5基因突变)相伴随。 在一些地区估计发生率在0.05%~0.24%,多数研究表明,男性较女性更常见, 通常在行超声心动图、心脏MRI或左心室造影后诊断。 在一些患者可出现左心室扩张和收缩功能不全。 患者也可能出现猝死等心律失常。 患者血栓栓塞风险增高,部分与致密不全区血栓形成有关。 遗传方式变化较大,已报道的与之相关的常见基因有tafazzin(X-连锁)、ZASP、线粒体基因和其他肌节基因等。[27]Pantazis AA, Elliott PM. Left ventricular noncompaction. Curr Opin Cardiol. 2009;24:209-213.http://www.ncbi.nlm.nih.gov/pubmed/19318934?tool=bestpractice.com 家族其他成员也需要进行筛查。[28]Captur G, Nihoyannopoulos P. Left ventricular non-compaction: genetic heterogeneity, diagnosis and clinical course. Int J Cardiol. 2010;140:145-153.http://www.ncbi.nlm.nih.gov/pubmed/19664830?tool=bestpractice.com
 [Figure caption and citation for the preceding image starts]: 二维心脏超声诊断(Chin et al and Jenni et al)左心室致密化不全(LVNC)标准:A.胸骨旁短轴显示右心室心腔呈新月形、左心室心尖部心肌致密化不全。 B.Chin标准: 为了描述小梁间隙穿透深度,Chin等提出了X/Y比值,其中X代表心外膜表面至小梁陷窝的距离,Y代表心外膜表面到小梁顶点的距离。 在这个LVNC标准中,X/Y≤0.5。 C.Jenni标准: 描述了左心室壁由 2 层构成,即外部致密层 C(与心外膜相邻),和内部非致密层 N。收缩末期非致密层和致密层的厚度取自胸骨旁短轴切面中左心室壁的最大厚度区域。 NC/C>2提示LVNC。改编自 Captur G, Nihoyannopoulos P. Left ventricular non-compaction: genetic heterogeneity, diagnosis and clinical course. Int J Cardiol. 2010;140:145-153. 经许可后使用。 [Citation ends].
[Figure caption and citation for the preceding image starts]: 二维心脏超声诊断(Chin et al and Jenni et al)左心室致密化不全(LVNC)标准:A.胸骨旁短轴显示右心室心腔呈新月形、左心室心尖部心肌致密化不全。 B.Chin标准: 为了描述小梁间隙穿透深度,Chin等提出了X/Y比值,其中X代表心外膜表面至小梁陷窝的距离,Y代表心外膜表面到小梁顶点的距离。 在这个LVNC标准中,X/Y≤0.5。 C.Jenni标准: 描述了左心室壁由 2 层构成,即外部致密层 C(与心外膜相邻),和内部非致密层 N。收缩末期非致密层和致密层的厚度取自胸骨旁短轴切面中左心室壁的最大厚度区域。 NC/C>2提示LVNC。改编自 Captur G, Nihoyannopoulos P. Left ventricular non-compaction: genetic heterogeneity, diagnosis and clinical course. Int J Cardiol. 2010;140:145-153. 经许可后使用。 [Citation ends].
离子通道病
包括长QT间期综合征(常染色体显性或隐性遗传)、Brugada综合征、儿茶酚胺敏感性多形性室性心动过速(常染色体显性或隐性遗传)、短QT间期综合征(常染色体显性遗传)、特发性心室颤动及病态窦房结综合征(常染色体显性遗传)。 需要指出的是,欧洲心脏病协会(ESC)并不同意将离子通道病纳入心肌病范畴。[3]Elliott P, Andersson B, Arbustini E, et al. Classification of the cardiomyopathies: a position statement from the European Society Of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2008;29:270-276.http://eurheartj.oxfordjournals.org/content/29/2/270.longhttp://www.ncbi.nlm.nih.gov/pubmed/17916581?tool=bestpractice.com
其他原发性遗传性心肌病包括传导系统疾病和线粒体心肌病。
原发性心肌病:混合型
扩张型心肌病 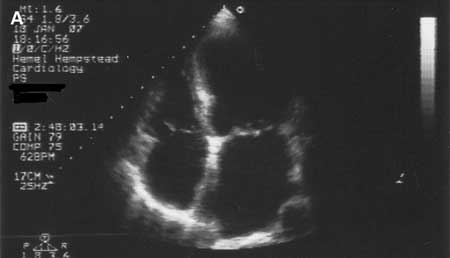 [Figure caption and citation for the preceding image starts]: 扩张型心肌病:超声心动图Tanejal AK, Wong J, Bayliss J. Antipsychotic-drug-induced dilated cardiomyopathy. BMJ 病例报告。 2009; doi:10.1136/bcr.09.2008.0958 [Citation ends].
[Figure caption and citation for the preceding image starts]: 扩张型心肌病:超声心动图Tanejal AK, Wong J, Bayliss J. Antipsychotic-drug-induced dilated cardiomyopathy. BMJ 病例报告。 2009; doi:10.1136/bcr.09.2008.0958 [Citation ends].
以左心室扩张和收缩功能失常为特征,且心脏负荷正常、除外冠心病, 也可表现为右心室扩张。 约有25%~35%为家族性。常染色体显性遗传及隐性遗传、X-连锁、线粒体相关的遗传等均有报道。[29]Towbin JA, Bowles NE. Dilated cardiomyopathy: a tale of cytoskeletal proteins and beyond. J Cardiovasc Electrophysiol. 2006;17:919-926.http://www.ncbi.nlm.nih.gov/pubmed/16764708?tool=bestpractice.com 当有猝死、传导系统疾病或相关骨骼肌病变家族史时,应怀疑为家族性疾病。欧洲心脏病学会 (ESC) 提出了一个修订版定义,根据成像参数将扩张型心肌病分为两种形式:扩张型心肌病和运动功能减退性非扩张型心肌病。[30]Pinto YM, Elliott PM, Arbustini E, et al. Proposal for a revised definition of dilated cardiomyopathy, hypokinetic non-dilated cardiomyopathy, and its implications for clinical practice: a position statement of the ESC working group on myocardial and pericardial diseases. Eur Heart J. 2016;37:1850-1858.http://eurheartj.oxfordjournals.org/content/37/23/1850.longhttp://www.ncbi.nlm.nih.gov/pubmed/26792875?tool=bestpractice.com ESC 还提出了家族性疾病的定义,并提出了先证者照护路径以及家庭成员的临床和基因检查。2016 年,美国心脏协会 (American Heart Association) 总结了目前对扩张型心肌病的理解,并根据具体病因提出了扩张型心肌病的适当管理建议。[31]American Heart Association. Current diagnostic and treatment strategies for specific dilated cardiomyopathies: A scientific statement from the American Heart Association. Nov 2016 [internet publication].http://circ.ahajournals.org/content/134/23/e579.longhttp://www.ncbi.nlm.nih.gov/pubmed/27832612?tool=bestpractice.com
一些与肌节相关的基因与肥厚型心肌病相关,也可能导致扩张型心肌病。[32]Jefferies JL, Towbin JA. Dilated cardiomyopathy. Lancet 2010;375:752-762.http://www.ncbi.nlm.nih.gov/pubmed/20189027?tool=bestpractice.com 核纤层蛋白A/C基因所致的心肌病表现型可有很大差异。从心脏预后看,诊断出受核纤层蛋白病影响的患者很重要,因为这些患者可以出现进展性传导系统疾病和猝死。[33]Malhotra R, Mason PK. Lamin A/C deficiency as a cause of familial dilated cardiomyopathy. Curr Opin Cardiol. 2009;24:203-208.http://www.ncbi.nlm.nih.gov/pubmed/19384091?tool=bestpractice.com 目前已认识到一系列情况可以导致扩张型心肌病。一个众所周知的原因是心肌炎后,该病患者经常感觉没有症状。其他原因包括:酒精、化疗药(蒽环类药物、曲妥珠单抗)、贮积病(血色病)、自体免疫和系统性疾病、神经肌肉疾病、线粒体疾病、代谢/内分泌疾病(甲状腺疾病、糖尿病、[34]Boudina S, Abel ED. Diabetic cardiomyopathy, causes and effects. Rev Endocr Metab Disord. 2010;11:31-39.http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2914514/?tool=pubmedhttp://www.ncbi.nlm.nih.gov/pubmed/20180026?tool=bestpractice.com 肢端肥大症、嗜铬细胞瘤)以及营养障碍(特别是缺乏维生素 B1、硒、蛋白质等营养不良问题)。很多患者即使接受了大量检查,也未找到明确的病因,这些被认为是特发性扩张型心肌病。
缺血性心肌病通常是指继发于心肌缺血的心脏功能障碍,在最新AHA分类中已被除外。[1]Maron BJ, Towbin JA, Thiene G, et al. Contemporary definitions and classification of the cardiomyopathies: an American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention. Circulation. 2006;113:1807-1816.http://circ.ahajournals.org/content/113/14/1807.full.pdf+htmlhttp://www.ncbi.nlm.nih.gov/pubmed/16567565?tool=bestpractice.com
限制性心肌病
限制型心肌的诊断主要基于发现心室充盈受限。 ESC工作组将扩张型心肌病定义为“在心脏舒张功能正常或减低,收缩功能正常或下降,室壁厚度均正常的情况下出现的充盈受限”。[3]Elliott P, Andersson B, Arbustini E, et al. Classification of the cardiomyopathies: a position statement from the European Society Of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2008;29:270-276.http://eurheartj.oxfordjournals.org/content/29/2/270.longhttp://www.ncbi.nlm.nih.gov/pubmed/17916581?tool=bestpractice.com 从广义上讲,它描述的是一种病理生理学状态,代表的不是单一的心肌病而是多种病理学或心肌病共有的特征。
它可能是原发性的、家族性的(可能与肌钙蛋白I或结蛋白基因变异相关,后者常与骨骼肌疾病相关),或与多种系统性疾病相关,如血色病、结节病、淀粉样变性、Fabry病、类癌综合征、硬皮病、蒽环类药物的毒性,或以前的辐射。 在儿童中一些罕见的代谢性疾病(Gaucher病或Hurler综合征)需要除外。
心内膜病理性改变(嗜酸性粒细胞增多综合征或心内膜心肌纤维化)也可能导致限制型心肌病。[35]Kushwaha SS, Fallon JT, Fuster V. Restrictive cardiomyopathy. N Engl J Med. 1997;336:267-276.http://www.ncbi.nlm.nih.gov/pubmed/8995091?tool=bestpractice.com 患者主要表现为呼吸困难或心悸,这些可能与心室舒张功能失常有关。 颈静脉压力经常是增高的。 典型的心电图表现为双心房肥厚伴非特异性ST-T波改变。 超声心动图或心脏MRI等表现为双心房增大伴舒张功能失常,基于二尖瓣多普勒形式及组织多普勒信号。
它的表现可能与缩窄性心包炎相似,必须将限制型心肌病与缩窄性心包炎区分开,这可能需要心脏导管术。 经选择的病例行心内膜活检可能有助于诊断。[36]Zangwill S, Hamilton R. Restrictive cardiomyopathy. Pacing Clin Electrophysiol. 2009;32(Suppl 2):S41-S43.http://www.ncbi.nlm.nih.gov/pubmed/19602161?tool=bestpractice.com 利尿剂可用于控制症状。需要注意的是,利尿剂可减少心脏前负荷,结果可能适得其反。 患者可能有复杂的心律失常,包括心房颤动、室性心动过速,可能需要埋藏式心脏除颤起搏器(ICD)等管理室速。
原发性心肌病:获得性
炎症性心肌炎
可影响心脏的获得性急、慢性炎症种类较多,如感染、中毒和药物。 一般认为可分急性期、愈合期、愈合后期。 标准的Dallas病理准则要求在标准组织学评估中有炎症浸润,伴或不伴心肌坏死。[37]Cooper LT Jr. Myocarditis. N Engl J Med. 2009;360:1526-1538.http://www.ncbi.nlm.nih.gov/pubmed/19357408?tool=bestpractice.com 然而,新的诊断标准已经开发了基于细胞特异性免疫组织化学染色特异性抗原。
由于心内膜活检有很大的风险,故根据疾病的可能性来推荐。[38]Cooper LT, Baughman KL, Feldman AM, et al. The role of endomyocardial biopsy in the management of cardiovascular disease. Circulation. 2007;116:2216-2233.http://circ.ahajournals.org/cgi/content/full/116/19/2216http://www.ncbi.nlm.nih.gov/pubmed/17959655?tool=bestpractice.com 两种最常见的表现需要警惕暴发性心肌炎、巨细胞性心肌炎:1)难以解释的病程短于2周的新发心力衰竭,心脏大小正常或左心室扩张而血流动力学下降;2)难以解释的病程在2周至3个月的新发心力衰竭,左心室扩张伴室性心律失常或高度房室传导阻滞,或1-2周常规治疗无效。 心脏MRI检查为可选诊断手段。 有研究提示,心肌炎急性活动期与异常MRI信号相关。
压力激发(tako-tsubo)
压力性心肌病主要症状和体征与急性心肌梗死相似,但没有明显的冠状动脉疾病或痉挛 (得名因发作时心脏形态与日本捕捉章鱼的笼子相似)。[39]Akashi YJ, Goldstein DS, Barbaro G, et al. Takotsubo cardiomyopathy: a new form of acute, reversible heart failure. Circulation. 2008;118:2574-2762.http://circ.ahajournals.org/cgi/content/full/118/25/2754http://www.ncbi.nlm.nih.gov/pubmed/19106400?tool=bestpractice.com 一些学者将本病命名为“短暂性心尖部气球样变和应激性心肌病”。  [Figure caption and citation for the preceding image starts]: 在tako-tsubo心肌病中左心室心尖部呈球形Augustine DX, Domanski A, Garg A. The stress of chest pain: a case of tako-tsubo cardiomyopathy. BMJ 病例报告。 2009; doi:10.1136/bcr.03.2009.1660 [Citation ends].
[Figure caption and citation for the preceding image starts]: 在tako-tsubo心肌病中左心室心尖部呈球形Augustine DX, Domanski A, Garg A. The stress of chest pain: a case of tako-tsubo cardiomyopathy. BMJ 病例报告。 2009; doi:10.1136/bcr.03.2009.1660 [Citation ends].
患者主要表现为胸痛、ST段抬高、T波倒置,以及中度的心肌酶学标志物增高。 最常见于绝经后妇女,常由情绪激动或体力活动诱发。[40]Prasad A, Lerman A, Rihal CS. Apical ballooning syndrome (Tako-Tsubo or stress cardiomyopathy): a mimic of acute myocardial infarction. Am Heart J. 2008;155:408-417.http://www.ncbi.nlm.nih.gov/pubmed/18294473?tool=bestpractice.com 在急性发作期,可以观察到短暂的去甲肾上腺素水平增高。 安全度过急性期的患者,左心室功能常可在数周内恢复正常。
很多组织制定了诊断标准。 最常用的是Mayo临床标准(首次发表于2004年,2008年进行了修订):[39]Akashi YJ, Goldstein DS, Barbaro G, et al. Takotsubo cardiomyopathy: a new form of acute, reversible heart failure. Circulation. 2008;118:2574-2762.http://circ.ahajournals.org/cgi/content/full/118/25/2754http://www.ncbi.nlm.nih.gov/pubmed/19106400?tool=bestpractice.com
左心室中间部暂时性低运动、不运动或运动失调,有或没有心尖部受累;运动失调范围超过单一血管支配区;常有压力诱因,也可以没有。
没有阻塞性冠状动脉疾病或血管造影未见急性斑块破裂证据
新发的心电图异常(ST段抬高和/或T波导致)或肌钙蛋白中度升高
没有嗜铬细胞瘤/心肌炎。
围产期心肌病
欧洲心脏病学会围产期心肌病 (peripartum cardiomyopathy, PPCM) 工作小组将围产期心肌病定义为一种特发性心肌病,频繁表现为在妊娠将要结束时或分娩后数月出现继发于左心室收缩功能不全(LVEF<45%)的心力衰竭,而未发现其他心力衰竭原因。[41]Sliwa K, Hilfiker-Kleiner D, Petrie MC, et al; Heart Failure Association of the European Society of Cardiology Working Group on Peripartum Cardiomyopathy. Current state of knowledge on aetiology, diagnosis, management, and therapy of peripartum cardiomyopathy: a position statement from the Heart Failure Association of the European Society of Cardiology Working Group on peripartum cardiomyopathy. Eur J Heart Fail. 2010;12:767-778.http://onlinelibrary.wiley.com/doi/10.1093/eurjhf/hfq120/fullhttp://www.ncbi.nlm.nih.gov/pubmed/20675664?tool=bestpractice.com[42]Bauersachs J, Arrigo M, Hilfiker-Kleiner D, et al. Current management of patients with severe acute peripartum cardiomyopathy: practical guidance from the Heart Failure Association of the European Society of Cardiology Study Group on peripartum cardiomyopathy. Eur J Heart Fail. 2016 Sep;18(9):1096-105.http://onlinelibrary.wiley.com/doi/10.1002/ejhf.586/abstracthttp://www.ncbi.nlm.nih.gov/pubmed/27338866?tool=bestpractice.com该病较少见,据估计发生率约为 1/4000 次生产。[43]Brar SS, Khan SS, Sandhu GK, et al. Incidence, mortality, and racial differences in peripartum cardiomyopathy. Am J Cardiol. 2007;100:302-304.http://www.ncbi.nlm.nih.gov/pubmed/17631087?tool=bestpractice.com 据报道,年龄大于 30 岁女性的发生率增高,且与妊娠期高血压及双胞胎妊娠相关。在非洲裔美国女性中发病率高得多,而在西班牙裔女性中发病率较低。一些患者在妊娠早期表现出来,这种情况被归类为妊娠早期相关性心肌病。[44]Elkayam U, Akhter MW, Singh H, et al. Pregnancy-associated cardiomyopathy: clinical characteristics and a comparison between early and late presentation. Circulation. 2005;111:2050-2055.http://circ.ahajournals.org/cgi/content/full/111/16/2050http://www.ncbi.nlm.nih.gov/pubmed/15851613?tool=bestpractice.com
可能与很多机制相关(如心肌炎、免疫、血流动力学因素)。 高达50%的患者可完全恢复,而其他患者可进展为严重的心力衰竭甚至需要心脏移植。 这种情况似乎有较高的发病率。[45]Goland S, Modi K, Bitar F, et al. Clinical profile and predictors of complications in peripartum cardiomyopathy. J Card Fail. 2009;15:645-650.http://www.ncbi.nlm.nih.gov/pubmed/19786252?tool=bestpractice.com氧化应激和产生有心脏毒性的催乳素亚片段可能在围产期心肌病 (PPCM) 的病理生理过程中发挥了关键作用。因此,用药物阻断催乳素提供了一种疾病特异性治疗的可能性。[41]Sliwa K, Hilfiker-Kleiner D, Petrie MC, et al; Heart Failure Association of the European Society of Cardiology Working Group on Peripartum Cardiomyopathy. Current state of knowledge on aetiology, diagnosis, management, and therapy of peripartum cardiomyopathy: a position statement from the Heart Failure Association of the European Society of Cardiology Working Group on peripartum cardiomyopathy. Eur J Heart Fail. 2010;12:767-778.http://onlinelibrary.wiley.com/doi/10.1093/eurjhf/hfq120/fullhttp://www.ncbi.nlm.nih.gov/pubmed/20675664?tool=bestpractice.com
心动过速导致的心肌病
在特定的人群中,长时间的与房性心动过速、心房颤动以及室性心动过速相关的快速心律失常可导致快速心律失常相关性心肌病。[46]Shinbane JS, Wood MA, Jensen DN, et al. Tachycardia-induced cardiomyopathy: a review of animal models and clinical studies. J Am Coll Cardiol. 1997;29:709-15.http://www.ncbi.nlm.nih.gov/pubmed/9091514?tool=bestpractice.com 在心室率得到控制后心脏损害可以逆转是诊断快速心律失常性心肌病的重要条件。[47]Calò L, De Ruvo E, Sette A, et al. Tachycardia-induced cardiomyopathy: mechanisms of heart failure and clinical implications. J Cardiovasc Med. 2007;8:138-143.http://www.ncbi.nlm.nih.gov/pubmed/17312430?tool=bestpractice.com
继发性心肌病
继发性心肌病表现为全身性、系统性疾病(多器官)导致的心脏损害。 在1995年制定的心肌病分类标准中称为特异性心肌病。 在WHO(世界卫生组织)的声明中认为该诊断在临床应用中可能是模糊的,依靠摳鋈硕粤俅仓匾院托脑嘈院蠊呐卸蠑。[1]Maron BJ, Towbin JA, Thiene G, et al. Contemporary definitions and classification of the cardiomyopathies: an American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention. Circulation. 2006;113:1807-1816.http://circ.ahajournals.org/content/113/14/1807.full.pdf+htmlhttp://www.ncbi.nlm.nih.gov/pubmed/16567565?tool=bestpractice.com
异常浸润或累积常可导致心肌病,常见原因如下。
淀粉样变性(肥厚型或限制型):以淀粉样纤维沉积在心脏为特征,疾病谱广泛,包括原发性淀粉样变性、家族性淀粉样多发性神经病及老年性心脏淀粉样变性。[48]Maredia N, Ray SG. Cardiac amyloidosis. Clin Med. 2005;5:504-509.http://www.ncbi.nlm.nih.gov/pubmed/16268336?tool=bestpractice.com 患者的症状和体征主要表现为心力衰竭或心律失常。 多因心电图或心脏超声检查异常而由心血管专家诊断。 心电图特征包括低电压、前壁或下壁导联假性心肌梗死、室性或室上性心动过速。 超声心动可见室壁厚度增加和心肌回声增强(散点),伴瓣膜增厚,常伴随少量心包积液。 特征性表现为心脏影像学肥厚与心电图低电压呈反比。 由于心脏MRI有全心心内膜下钆延迟显像增强的特征,使用MRI来诊断本病正在逐渐增加。 常活检受累组织得到病理学确诊。 已开展化疗、干细胞移植及心脏移植等方法,但结局各异。 地高辛可结合在淀粉样变组织中导致出现难以预期的药物代谢,应避免使用。
Gaucher病(限制型)
黏多糖症(Hunter综合征和Hurler病,主要为扩张)[49]Guertl B, Noehammer C, Hoefler G. Metabolic cardiomyopathies. Int J Exp Pathol. 2000;81:349-372.http://www.ncbi.nlm.nih.gov/pubmed/11298185?tool=bestpractice.com
血色病(扩张或限制型):经典的血色病是一种与HFE基因突变相关的常染色体隐性遗传性疾病,导致铁过载。 它是一种多系统疾病,心脏受累主要表现为进行性心脏扩张,导致心力衰竭和传导系统障碍。[50]Lubitz SA, Goldbarg SH, Mehta D. Sudden cardiac death in infiltrative cardiomyopathies: sarcoidosis, scleroderma, amyloidosis, hemachromatosis. Prog Cardiovasc Dis. 2008;51:58-73.http://www.ncbi.nlm.nih.gov/pubmed/18634918?tool=bestpractice.com 去除铁可逆转早期改变。 使用心脏MRI很容易发现心脏受累并检测到铁。
Fabry病(肥型或限制型)
Pompe症(2型糖原贮积病,肥厚型)
Niemann-Pick病(肥厚型)
铁过载状态,包括地中海贫血。
严重中毒导致的心肌病。
阿霉素与心肌病的发生之间存在很强的相关性。[51]Bristow MR, Mason JW, Billingham ME, et al. Doxorubicin cardiomyopathy: evaluation by phonocardiography, endomyocardial biopsy, and cardiac catheterization. Ann Intern Med. 1978;88:168-175.http://www.ncbi.nlm.nih.gov/pubmed/626445?tool=bestpractice.com 曲妥珠单抗治疗也可导致心肌病。[52]Guglin M, Hartlage G, Reynolds C, et al. Trastuzumab-induced cardiomyopathy: not as benign as it looks? A retrospective study. J Card Fail. 2009;15:651-657.http://www.ncbi.nlm.nih.gov/pubmed/19786253?tool=bestpractice.com
慢性酒精摄入可导致直接的心肌损害,如凋亡,也可能与维生素B1缺乏及湿脚气病的进展相关(尽管确切的机制尚不清楚)。[53]Fernández-Solà J, Fatjó F, Sacanella E, et al. Evidence of apoptosis in alcoholic cardiomyopathy. Hum Pathol. 2006;37:1100-1110.http://www.ncbi.nlm.nih.gov/pubmed/16867874?tool=bestpractice.com
添加到啤酒中的钴、接触某些化学物质如重金属也可导致心肌损害。[54]Alexander CS. Cobalt-beer cardiomyopathy. A clinical and pathologic study of twenty-eight cases. Am J Med. 1972;53:395-417.http://www.ncbi.nlm.nih.gov/pubmed/4263183?tool=bestpractice.com
内分泌失调可导致心肌病,可以表现为扩张型或限制型心肌病,虽然证据来自有限的病例报告。
由于心肌的糖基化及继发的舒张功能失常,糖尿病可导致浸润型/限制型心肌病。[55]Galderisi M. Diastolic dysfunction and diabetic cardiomyopathy: evaluation by Doppler echocardiography. J Am Coll Cardiol. 2006;48:1548-1551.http://www.ncbi.nlm.nih.gov/pubmed/17045886?tool=bestpractice.com 在疑诊断糖尿病心肌病患者中很重要的一点是排除冠状动脉疾病所致。
心肌病也可以由甲状腺功能亢进症/甲状腺功能减退症、甲状旁腺功能亢进、嗜铬细胞瘤、肢端肥大症等引起。
心肌病是用以识别心面综合征的一个特征。
Noonan 综合征。
雀斑样痣性心肌病[18]Sarkozy A, Digilio MC, Dallapiccola B. Leopard syndrome. Orphanet J Rare Dis. 2008;3:13.http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2467408/?tool=pubmedhttp://www.ncbi.nlm.nih.gov/pubmed/18505544?tool=bestpractice.com
各种维生素和矿物质等营养不足可导致心肌病的发生。
维生素B1缺乏导致高排性心力衰竭,被称为湿性脚气病。 已有很多病理生理机制被提出,但公认的是起始为线粒体损害进而导致心肌病。[56]Akbarian M, Yankopoulos NA, Abelmann WH. Hemodynamic studies in beriberi heart disease. Am J Med. 1966;41:197-212.http://www.ncbi.nlm.nih.gov/pubmed/5912298?tool=bestpractice.com
其他的营养元素如维生素C、烟酸、硒、维生素D缺乏也可能导致心肌病。
其他病因
神经肌肉及神经疾病如Friedreich共济失调、肌营养不良症(Duchenne、Becker和Emery-Dreifuss肌营养不良,强直性肌营养不良症)等可参与心肌病的发生。
自身免疫性疾病如系统性红斑狼疮
结节病是一种原因不明的全身性肉芽肿性疾病。 明显的心脏受累是罕见的,患者可能会出现心力衰竭(由于发展为心肌病),缓慢性心律失常/高度房室传导阻滞,或室性心律失常导致猝死。[57]Kim JS, Judson MA, Donnino R, et al. Cardiac sarcoidosis. Am Heart J. 2009;157:9-21.http://www.ncbi.nlm.nih.gov/pubmed/19081391?tool=bestpractice.com 亚临床心脏损害常见,很多病例是在尸检后发现的。 肉芽肿性损害往往是片状的,心内膜心肌活检确诊率低。 已有多个不尽相同的诊断标准。[50]Lubitz SA, Goldbarg SH, Mehta D. Sudden cardiac death in infiltrative cardiomyopathies: sarcoidosis, scleroderma, amyloidosis, hemachromatosis. Prog Cardiovasc Dis. 2008;51:58-73.http://www.ncbi.nlm.nih.gov/pubmed/18634918?tool=bestpractice.com 心脏结节病的症状和晕厥患者应积极的调查和以器械为基础的治疗,包括ICD置入。 作为一种很有用的成像技术,心脏MRI的应用越来越多。 可征求呼吸等专家的建议。 为治疗潜在的病因,免疫抑制治疗是必要的。
电解质失衡:常见的有钾、磷、镁失衡。
心内膜纤维化
Loeffler心内膜炎/嗜酸性粒细胞增多综合征
 [Figure caption and citation for the preceding image starts]: 心尖肥厚型心肌病:心脏超声心动的增强性四腔心切面图Ahmed I, Smalley SJ, Zhu DWX, et al. Sudden cardiac arrest in apical hypertrophic cardiomyopathy. BMJ 病例报告。 2009;doi:10.1136/bcr.04.2009.17 [Citation ends].
[Figure caption and citation for the preceding image starts]: 心尖肥厚型心肌病:心脏超声心动的增强性四腔心切面图Ahmed I, Smalley SJ, Zhu DWX, et al. Sudden cardiac arrest in apical hypertrophic cardiomyopathy. BMJ 病例报告。 2009;doi:10.1136/bcr.04.2009.17 [Citation ends]. [Figure caption and citation for the preceding image starts]: 二维心脏超声诊断(Chin et al and Jenni et al)左心室致密化不全(LVNC)标准:A.胸骨旁短轴显示右心室心腔呈新月形、左心室心尖部心肌致密化不全。 B.Chin标准: 为了描述小梁间隙穿透深度,Chin等提出了X/Y比值,其中X代表心外膜表面至小梁陷窝的距离,Y代表心外膜表面到小梁顶点的距离。 在这个LVNC标准中,X/Y≤0.5。 C.Jenni标准: 描述了左心室壁由 2 层构成,即外部致密层 C(与心外膜相邻),和内部非致密层 N。收缩末期非致密层和致密层的厚度取自胸骨旁短轴切面中左心室壁的最大厚度区域。 NC/C>2提示LVNC。改编自 Captur G, Nihoyannopoulos P. Left ventricular non-compaction: genetic heterogeneity, diagnosis and clinical course. Int J Cardiol. 2010;140:145-153. 经许可后使用。 [Citation ends].
[Figure caption and citation for the preceding image starts]: 二维心脏超声诊断(Chin et al and Jenni et al)左心室致密化不全(LVNC)标准:A.胸骨旁短轴显示右心室心腔呈新月形、左心室心尖部心肌致密化不全。 B.Chin标准: 为了描述小梁间隙穿透深度,Chin等提出了X/Y比值,其中X代表心外膜表面至小梁陷窝的距离,Y代表心外膜表面到小梁顶点的距离。 在这个LVNC标准中,X/Y≤0.5。 C.Jenni标准: 描述了左心室壁由 2 层构成,即外部致密层 C(与心外膜相邻),和内部非致密层 N。收缩末期非致密层和致密层的厚度取自胸骨旁短轴切面中左心室壁的最大厚度区域。 NC/C>2提示LVNC。改编自 Captur G, Nihoyannopoulos P. Left ventricular non-compaction: genetic heterogeneity, diagnosis and clinical course. Int J Cardiol. 2010;140:145-153. 经许可后使用。 [Citation ends]. [Figure caption and citation for the preceding image starts]: 扩张型心肌病:超声心动图Tanejal AK, Wong J, Bayliss J. Antipsychotic-drug-induced dilated cardiomyopathy. BMJ 病例报告。 2009; doi:10.1136/bcr.09.2008.0958 [Citation ends].
[Figure caption and citation for the preceding image starts]: 扩张型心肌病:超声心动图Tanejal AK, Wong J, Bayliss J. Antipsychotic-drug-induced dilated cardiomyopathy. BMJ 病例报告。 2009; doi:10.1136/bcr.09.2008.0958 [Citation ends]. [Figure caption and citation for the preceding image starts]: 在tako-tsubo心肌病中左心室心尖部呈球形Augustine DX, Domanski A, Garg A. The stress of chest pain: a case of tako-tsubo cardiomyopathy. BMJ 病例报告。 2009; doi:10.1136/bcr.03.2009.1660 [Citation ends].
[Figure caption and citation for the preceding image starts]: 在tako-tsubo心肌病中左心室心尖部呈球形Augustine DX, Domanski A, Garg A. The stress of chest pain: a case of tako-tsubo cardiomyopathy. BMJ 病例报告。 2009; doi:10.1136/bcr.03.2009.1660 [Citation ends].