简介
作者认为,以下方法是评估甲状腺肿块患者的关键要点。
判断肿物在甲状腺内还是外, 从病史、体格检查、影像学(超声和/或 CT)线索可以帮助鉴别二者。
颈部超声检查是评估颈部肿块结构和解剖位置的初步检查,并可评估其存在的影像学特征,为临床诊断提供线索。[26]Gharib H, Papini E, Garber JR, et al.; American Association of Clinical Endocrinologists, American College of Endocrinology, Associazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules - 2016 update. Endocr Pract. 2016 May;22(5):622-39.http://www.ncbi.nlm.nih.gov/pubmed/27167915?tool=bestpractice.com 它具有成本效益,并且不会使患者暴露于电离辐射。
评估甲状腺结节时,应总是通过超声检查评估颈部淋巴结。如果它们大于 1 cm(水平 I 和 II 为 1.5 厘米)并伴有其他恶性肿瘤体征(中心坏死、外周血管过多),应考虑进行超声引导下的针吸活检。
如果肿块或结节来自于甲状腺本身,需评估它的激素分泌活性。病史、体格检查以及游离 T4 与促甲状腺激素 (TSH) 测定被用于评估病变的功能状态。
弥漫性、非结节性甲状腺肿块可能是甲状腺炎或淋巴瘤所致,需根据症状的严重程度和病变的进展速度以及影像学表现来评估。
对于大小>1 cm 的离散型结节或者具有高风险特征的更小结节,应视情况进一步评估(例如在超声引导下获取的细胞学检查),以排除恶性病因,但需谨记绝大部分甲状腺结节为良性。孤立性甲状腺结节(2.7%-30.0% 的患者)比多发性结节腺体中单结节(1.4%-10.0% 的患者)为恶性的可能性更大。然而,由于每个结节的附加风险,单个实性结节腺体的恶变率与多结节腺体的恶变率大致相当。[27]Frates MC, Benson CB, Doubilet PM, et al. Prevalence and distribution of carcinoma in patients with solitary and multiple thyroid nodules on sonography. J Clin Endocrinol Metab. 2006 Sep;91(9):3411-7.http://jcem.endojournals.org/content/91/9/3411.longhttp://www.ncbi.nlm.nih.gov/pubmed/16835280?tool=bestpractice.com
单纯超声诊断不足以明确良恶性。对于需要明确诊断的甲状腺结节,当超声引导下细针穿刺 (FNA) 提供的信息具有临床影响时,应进行该检查。细胞学结果可指导进行适当的后续处理。当前指南不鼓励对小于 1 cm 的甲状腺结节进行常规活检。[5]Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4739132/http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com
在下列情况下,需对甲状腺结节进行外科手术干预(甲状腺腺叶切除术或甲状腺腺叶切除术):结节很大以至于引发症状时;基于细胞学检查结果担心为恶性肿瘤;有美观方面的顾虑,患者对病变感到焦虑;或者有必要明确诊断但通过 FNA 引导的细胞学检查无法明确时。此外,甲状腺腺叶切除术可能适用于小于 4 cm (T1-T4) 的已知甲状腺癌结节。
甲状腺结节≥4 cm 时需要外科手术,因为恶性比率高达 20%-30%,而用细针穿刺检测恶性肿瘤的假阴性率,也因抽样误差而增加。[28]McCoy KL, Jabbour N, Ogilvie JB, et al. The incidence of cancer and rate of false-negative cytology in thyroid nodules greater than or equal to 4 cm in size. Surgery. 2007 Dec;142(6):837-44.http://www.ncbi.nlm.nih.gov/pubmed/18063065?tool=bestpractice.com[29]Englum BR, Pura J, Reed SD, et al. A bedside risk calculator to preoperatively distinguish follicular thyroid carcinoma from follicular variant of papillary thyroid carcinoma. World J Surg. 2015 Dec;39(12):2928-34.http://www.ncbi.nlm.nih.gov/pubmed/26324158?tool=bestpractice.com
对于一些经选择的患者,在 FNA 之前或者诊断为乳头状癌之后,观察甲状腺结节成为一种选择,具体取决于肿瘤/颈部超声特征(例如原发肿瘤大小和在甲状腺内的位置)、个体情况(例如接受监测的意愿、年龄、并存疾病)以及多学科临床团队的经验。[7]Brito JP, Ito Y, Miyauchi A, et al. A clinical framework to facilitate risk stratification when considering an active surveillance alternative to immediate biopsy and surgery in papillary microcarcinoma. Thyroid. 2016 Jan;26(1):144-9.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4842944/http://www.ncbi.nlm.nih.gov/pubmed/26414743?tool=bestpractice.com[30]Ito Y, Miyauchi A, Oda H, et al. Revisiting low-risk thyroid papillary microcarcinomas resected without observation: was immediate surgery necessary? World J Surg. 2016 Mar;40(3):523-8.http://www.ncbi.nlm.nih.gov/pubmed/26243564?tool=bestpractice.com
以下部分更详细地解释了诊断方法。
病史
大多数甲状腺结节是无症状的, 但需要对患者进行以下评估:有无甲状腺功能亢进或低下的相关症状,有无局部压迫症状,如发音障碍、吞咽困难和呼吸困难。 甲状腺功能亢进症的症状包括易怒、多汗、怕热、心悸、震颤、焦虑、失眠、细脆发、肠蠕动增加和体重下降。 甲状腺功能减退症包括怕冷、便秘、体重增加、疲劳、干燥、皮肤瘙痒。 增加恶性肿瘤可能性的因素如下:[31]Hegedüs L. Clinical practice: the thyroid nodule. N Engl J Med. 2004 Oct 21;351(17):1764-71.http://www.ncbi.nlm.nih.gov/pubmed/15496625?tool=bestpractice.com
体格检查
体格检查包括对颈前部和侧方进行视诊和触诊,评估甲状腺是否增大,是否有甲状腺结节,是否有淋巴结肿大。要求患者在触诊时吞咽,可提高甲状腺的触及率和结节的检出率。甲状腺功能亢进表现包括:心动过速、心律失常、肌肉萎缩、震颤、腱反射亢进、毛发质脆。甲状腺功能减退的体征包括心动过缓、皮肤增厚和浮肿(黏液性水肿)和反射松弛期延长。如果患者有发音障碍,查看声带运动很重要。可通过使用牙科镜和头灯、超声检查或可曲式鼻咽镜予以完成。甲状腺肿块伴同侧声带麻痹,需引起对侵袭性甲状腺癌的怀疑。目前美国耳鼻喉-头颈外科学会的指南建议,对于有颈部肿块、被认为患恶性肿瘤风险增加的患者进行喉部检查。[32]Pynnonen MA, Gillespie MB, Roman B, et al. Clinical practice guideline: evaluation of the neck mass in adults. Otolaryngol Head Neck Surg. 2017 Sep;157(2 Suppl):S1-30.http://www.ncbi.nlm.nih.gov/pubmed/28891406?tool=bestpractice.com 这可能涉及到将患者转诊至另一名具备施行该针对性检查能力的医生。体格检查受限于患者的体型及检查者技能。甲状腺结节的物理特征对预测恶性肿瘤作用不大,但下面这些特征提示恶性高风险。[31]Hegedüs L. Clinical practice: the thyroid nodule. N Engl J Med. 2004 Oct 21;351(17):1764-71.http://www.ncbi.nlm.nih.gov/pubmed/15496625?tool=bestpractice.com
结节>4cm
触诊结节质地坚硬
与邻近组织粘连
颈部淋巴结肿大
声带麻痹
检查结果与颈部或上胸部受到过电离辐射史一致。
实验室评估
甲状腺结节的患者通常甲功是正常的,最简便的判定方法就是测定血清TSH水平。[26]Gharib H, Papini E, Garber JR, et al.; American Association of Clinical Endocrinologists, American College of Endocrinology, Associazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules - 2016 update. Endocr Pract. 2016 May;22(5):622-39.http://www.ncbi.nlm.nih.gov/pubmed/27167915?tool=bestpractice.com 如果 TSH 水平低于正常值(抑制),应进一步评估游离甲状腺素 (FT4) 或计算游离三碘甲状腺原氨酸 (FT3) 水平,以确诊甲状腺功能亢进。 部分医生喜欢同时检测TSH和FT4。 甲状腺结节伴发甲亢预示一个或多个自主功能性腺瘤,这种结节恶变的可能很低(<1%)。[33]Cases JA, Surks MI. The changing role of scintigraphy in the evaluation of thyroid nodules. Semin Nucl Med. 2000 Apr;30(2):81-7.http://www.ncbi.nlm.nih.gov/pubmed/10787188?tool=bestpractice.com 如果甲状腺结节是弥漫性增大,应该怀疑Graves病或者甲状腺炎。 放射性碘摄取和扫描通常可鉴别这几种疾病,在做此项检查前应先检测 FT4/TSH。[34]Khalid AN, Hollenbeak CS, Quraishi SA, et al. The cost-effectiveness of iodine 131 scintigraphy, ultrasonography, and fine-needle aspiration biopsy in the initial diagnosis of solitary thyroid nodules. Arch Otolaryngol Head Neck Surg. 2006 Mar;132(3):244-50.http://archotol.jamanetwork.com/article.aspx?articleid=484122http://www.ncbi.nlm.nih.gov/pubmed/16549743?tool=bestpractice.com 如果 TSH 升高,应进一步评估 FT4 和甲状腺自身抗体(考虑到桥本氏甲状腺炎)。
如果影像学特征提示结节或颈部肿块为增大的甲状旁腺,需测定血清中的总钙和游离钙以及甲状旁腺素水平。 对于有甲状腺髓样癌和多发内分泌腺瘤II型家族史的患者,需测定其血清降钙素水平, 但不推荐把降钙素作为甲状腺结节患者的常规检查。[5]Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4739132/http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com
超声检查
颈部超声是甲状腺结节和许多其他颈部解剖病变首选的影像学检查方法。 超声检查可以发现触诊发现不了的小结节并明确结节特征,可以明确颈部中央和两侧淋巴结病变情况,并可通过连续监测准确了解结节大小的变化情况。[26]Gharib H, Papini E, Garber JR, et al.; American Association of Clinical Endocrinologists, American College of Endocrinology, Associazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules - 2016 update. Endocr Pract. 2016 May;22(5):622-39.http://www.ncbi.nlm.nih.gov/pubmed/27167915?tool=bestpractice.com 通常,炎症(例如亚急性甲状腺炎、桥本氏甲状腺炎和慢性甲状腺炎)可导致甲状腺不均匀回声,结合相关的淋巴结病,对诊断有提示作用。 炎症还可导致假结节的形成,这是由于局部异质性所导致的模糊区域而非真正的结节病变。 当超声转换90度时,假结节可视化,病变即消失。 假结节不需要做细针穿刺,由甲状腺炎引发时,需关注假结节是否随甲状腺炎的康复而消失。 甲状腺结节的大小及影像学特征决定是否需进一步做细针活检。 恶性病变不能通过超声来确诊或排除。 但是,有以下超声表现需高度怀疑恶性,需要做细针穿刺:[3]Papini E, Guglielmi R, Bianchini A, et al. Risk of malignancy in nonpalpable thyroid nodules: predictive value of ultrasound and color-Doppler features. J Clin Endocrinol Metab. 2002 May;87(5):1941-6.http://jcem.endojournals.org/content/87/5/1941.longhttp://www.ncbi.nlm.nih.gov/pubmed/11994321?tool=bestpractice.com
微钙化
血管晕的缺失
不规则边缘
高宽比失衡
超声表现为相较于甲状腺实质区域的低回声
结节内血管增多
FNA 检查与否的阈值大小取决于超声特征,但通常超过 1 厘米。如果存在高风险病史或 X 线检查有可疑表现,应考虑对>1 cm 的结节进行 FNA 活检。在某些病例中,观察到部分此类病变后,医生和患者之间可能需要进行讨论。在局部转移性甲状腺癌患者中,对于所有可疑的淋巴结,如果活检会改变治疗方案,则应行活检检查,因为如果不治疗,位置接近气管或颈动脉的淋巴结可能会出现并发症。然而,在一些情况下,观察淋巴结即可。偶然发现的可触及实性结节,如果直径≥1 cm,即使没有高危的超声影像特点,也应做 FNA 活检。对于无高危超声影像特点的混合型囊实性结节,和≥2 cm 海绵状结节,需要用 FNA 进行评估。[5]Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4739132/http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com 之前活检过的结节,如果体积增大超过50%,应该考虑再次活检。[5]Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4739132/http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com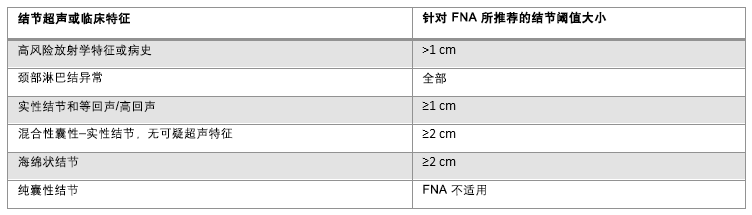 [Figure caption and citation for the preceding image starts]: 结节的超声特征和细针穿刺的结节大小阈值由 BMJ 知识中心和 Dr B.C.Stack Jr 编制;改编自 Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133 [Citation ends].
[Figure caption and citation for the preceding image starts]: 结节的超声特征和细针穿刺的结节大小阈值由 BMJ 知识中心和 Dr B.C.Stack Jr 编制;改编自 Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133 [Citation ends].
放射性核素显像
如果TSH被抑制,应该做放射性核素显像以识别自主高功能结节(热结节)并区别是Graves病还是甲状腺炎。 如果显示局灶性放射性同位素摄取增加伴周围实质组织放射性同位素摄取受抑制,则甲状腺结节恶性风险小于1%。 如果放射性核素表现为热结节,没有其他特征或家族史的话无需再做FNA。[33]Cases JA, Surks MI. The changing role of scintigraphy in the evaluation of thyroid nodules. Semin Nucl Med. 2000 Apr;30(2):81-7.http://www.ncbi.nlm.nih.gov/pubmed/10787188?tool=bestpractice.com 不再推荐放射性核素扫描用于“冷结节”的风险分层,因为在鉴别良恶性方面相较于超声及细针穿刺它没有表现出额外的优势[34]Khalid AN, Hollenbeak CS, Quraishi SA, et al. The cost-effectiveness of iodine 131 scintigraphy, ultrasonography, and fine-needle aspiration biopsy in the initial diagnosis of solitary thyroid nodules. Arch Otolaryngol Head Neck Surg. 2006 Mar;132(3):244-50.http://archotol.jamanetwork.com/article.aspx?articleid=484122http://www.ncbi.nlm.nih.gov/pubmed/16549743?tool=bestpractice.com
CT和MRI
在甲状腺结节的初始评估中,CT 和 MRI(横断面成像)不发挥重要作用;然而,它们可用于精确测量与评估大的胸骨后甲状腺肿,并用来识别超声发现不了的淋巴结。[26]Gharib H, Papini E, Garber JR, et al.; American Association of Clinical Endocrinologists, American College of Endocrinology, Associazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules - 2016 update. Endocr Pract. 2016 May;22(5):622-39.http://www.ncbi.nlm.nih.gov/pubmed/27167915?tool=bestpractice.com 此外,它们也有助于识别向后扩展的巨大甲状腺肿和弥漫性大体积的腺病。 CT扫描时须谨慎使用碘造影剂,因为这会妨碍后续诊断性和治疗性放射性碘应用,至少4-8周或者更长时间。 碘对比剂还可导致Jod-Basedow效应(碘剂诱导甲亢),还可加剧Graves病及毒性甲状腺肿的甲亢症状。 给予碘造影剂进行 CT 后,如果对放射性碘的治疗用途存在担心,可以进行 24 小时尿样收集并检测尿碘。
正电子发射断层扫描 (positron emission tomography, PET)
FDG-PET扫描对判断恶性病变敏感性高但特异性低,而且不同的研究结果也不尽相同。[35]Hales NW, Krempl GA, Medina JE. Is there a role for fluorodeoxyglucose positron emission tomography/computed tomography in cytologically indeterminate thyroid nodules? Am J Otolaryngol. 2008 Mar-Apr;29(2):113-8.http://www.ncbi.nlm.nih.gov/pubmed/18314022?tool=bestpractice.com 因此,FDG-PET在早期诊断甲状腺结节时不推荐。 然而,任何偶然发现的FDG聚集的甲状腺结节都值得全面评估恶性可能。[36]Razfar A, Branstetter BF 4th, Christopoulos A, et al. Clinical usefulness of positron emission tomography-computed tomography in recurrent thyroid carcinoma. Arch Otolaryngol Head Neck Surg. 2010 Feb;136(2):120-5.http://archotol.ama-assn.org/cgi/content/full/136/2/120http://www.ncbi.nlm.nih.gov/pubmed/20157055?tool=bestpractice.com 评估应包括颈部超声检查,如果基于患者病史及结节影像学特征提示有指征,则随后进行 FNA。[37]Boeckmann J, Bartel T, Siegel E, et al. Can the pathology of a thyroid nodule be determined by positron emission tomography uptake? Otolaryngol Head Neck Surg. 2012 Jun;146(6):906-12.http://www.ncbi.nlm.nih.gov/pubmed/22307576?tool=bestpractice.com PET 检查时的甲状腺弥散性摄取可被认为患有桥本氏甲状腺炎。
细针穿刺
超声检查之后,由超声引导的 FNA 是评估可疑甲状腺结节的首选方法。 细胞学与辅助分子遗传学检查决定是否需要外科手术。 操作过程可耐受且并发症风险低。 局部疼痛、血肿是最常见的并发症,严重不良事件很罕见[38]Polyzos SA, Anastasilakis AD. Clinical complications following thyroid fine-needle biopsy: a systematic review. Clin Endocrinol (Oxf). 2009 Aug;71(2):157-65.http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2265.2009.03522.x/fullhttp://www.ncbi.nlm.nih.gov/pubmed/19170717?tool=bestpractice.com 细针穿刺提高了诊断的准确性,手术时证实为恶性肿瘤的比率更高,并显著减少了治疗费用。[39]Gharib H, Papini E. Thyroid nodules: clinical importance, assessment, and treatment. Endocrinol Metab Clin North Am. 2007 Sep;36(3):707-35.http://www.ncbi.nlm.nih.gov/pubmed/17673125?tool=bestpractice.com 与未引导的 FNA 相比,超声引导下的局部细针抽吸活检降低了样本量不足的发生率。[40]Cesur M, Corapcioglu D, Bulut S, et al. Comparison of palpation-guided fine-needle aspiration biopsy to ultrasound-guided fine-needle aspiration biopsy in the evaluation of thyroid nodules. Thyroid. 2006 Jun;16(6):555-61.http://www.ncbi.nlm.nih.gov/pubmed/16839257?tool=bestpractice.com
高质量的细胞学涂片检查对诊断来说是必不可少的,必须在技术娴熟、细胞材料和胶体准备充分的情况下,才能获得更好的评估效果。 细针穿刺的细胞学检查结果包括:不满意、良性、不确定性、可疑恶性和恶性。 大约10%-20%的细胞学检查示不满意或者不充分,60%-75%是良性的,6%-10%是可疑恶性或者恶性的。[41]Theoharis CG, Schofield KM, Hammers L, et al. The Bethesda thyroid fine-needle aspiration classification system: year 1 at an academic institution. Thyroid. 2009 Nov;19(11):1215-23.http://www.ncbi.nlm.nih.gov/pubmed/19888859?tool=bestpractice.com[42]Jo VY, Stelow EB, Dustin SM, et al. Malignancy risk for fine-needle aspiration of thyroid lesions according to the Bethesda system for reporting thyroid cytopathology. Am J Clin Pathol. 2010 Sep;134(3):450-6.http://www.ncbi.nlm.nih.gov/pubmed/20716802?tool=bestpractice.com 各学会的专业术语不尽相同。 这促使了Bethesda分类系统的发展,并在美国得到普遍应用,还没有被全球采纳。[43]Bumpous J, Celestre MD, Pribitkin E, et al. Decision making for diagnosis and management: algorithms from experts for molecular testing. Otolaryngol Clin North Am. 2014 Aug;47(4):609-23.http://www.ncbi.nlm.nih.gov/pubmed/25041961?tool=bestpractice.com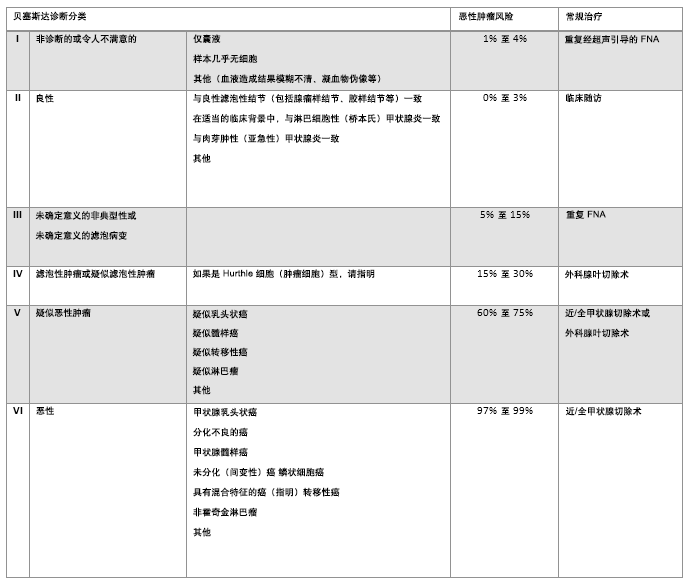 [Figure caption and citation for the preceding image starts]: Bethesda 系统用于甲状腺细胞病理学报告:推荐诊断分类、提示恶性风险和推荐的临床治疗。风险百分比取决于当地病理学家报告的异型性,和滤泡性病变的比率。对于外科医生来说,充分理解病理学家所报告各种 Bethesda 分类甲状腺结节的分级及其原理。处理可能取决于许多因素,例如结节大小、伴随症状、患者焦虑情绪以及细针穿刺 (FNA) 解读结果由 BMJ 知识中心编制;改编自 Bumpous J, Celestre MD, Pribitkin E, et al.Decision making for diagnosis and management: algorithms from experts for molecular testing.Otolaryngol Clin North Am.2014 Aug;47(4):609-23 [Citation ends].
[Figure caption and citation for the preceding image starts]: Bethesda 系统用于甲状腺细胞病理学报告:推荐诊断分类、提示恶性风险和推荐的临床治疗。风险百分比取决于当地病理学家报告的异型性,和滤泡性病变的比率。对于外科医生来说,充分理解病理学家所报告各种 Bethesda 分类甲状腺结节的分级及其原理。处理可能取决于许多因素,例如结节大小、伴随症状、患者焦虑情绪以及细针穿刺 (FNA) 解读结果由 BMJ 知识中心编制;改编自 Bumpous J, Celestre MD, Pribitkin E, et al.Decision making for diagnosis and management: algorithms from experts for molecular testing.Otolaryngol Clin North Am.2014 Aug;47(4):609-23 [Citation ends].
不满意的细胞学结果需要重复细针穿刺, 超声引导下的第二次细针穿刺可取得令人满意的诊断标本,在实性结节可达75%,在囊性结节可达50%。[44]Alexander EK, Heering JP, Benson CB, et al. Assessment of nondiagnostic ultrasound-guided fine needle aspirations of thyroid nodules. J Clin Endocrinol Metab. 2002 Nov;87(11):4924-7.http://jcem.endojournals.org/content/87/11/4924.longhttp://www.ncbi.nlm.nih.gov/pubmed/12414851?tool=bestpractice.com 如果在 2 次尝试后结果仍不令人满意,应考虑做诊断性腺叶切除术(偏侧甲状腺切除术)。
FNA 提示,在细胞学良性的非囊性病变中仍有高达 5% 的恶性风险,这在≥4 cm 的结节中该风险甚至可能更高(可能来自抽样误差)。 因此,这种结节仍需要每年通过颈部检查和颈部超声检查进行随访。[45]Chehade JM, Silverberg AB, Kim J, et al. Role of repeated fine-needle aspiration of thyroid nodules with benign cytologic features. Endocr Pract. 2001 Jul-Aug;7(4):237-43.http://www.ncbi.nlm.nih.gov/pubmed/11497473?tool=bestpractice.com 抽吸的囊性成分常由于缺乏细胞或胶质成分,而得出不充分或不确定的细胞学结果。大多数囊性结节是混合型的(囊实性病变)。除非有症状,否则单纯性囊肿一般不需要 FNA,因为恶性可能性极低,但是对于单纯性囊肿,如果获得的抽吸结果不满意或不确定,可以保守处理,通常不需要进一步干预。对于 Bethesda 标准细胞学诊断为意义未明非典型性/不明确的滤泡性病变,或诊断相当的结节性病变,需要在 4 至 6 周后,待前一次FNA 孔道愈合,重新进行 FNA。[46]Baloch ZW, Cibas ES, Clark DP, et al. The National Cancer Institute Thyroid fine needle aspiration state of the science conference: a summation. Cytojournal. 2008 Apr 7;5:6.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2365970/http://www.ncbi.nlm.nih.gov/pubmed/18394201?tool=bestpractice.com 如果是可疑恶性或细胞学恶性的滤泡肿瘤,应推荐至经验丰富的内分泌科医生及头颈外科医生做进一步处理。 对这样的患者做细针穿刺活检的分子学检测是最合适的。
美国甲状腺学会及英国甲状腺学会也有各自的分类系统,可以映射到 Bethesda 分类系统。[5]Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4739132/http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com[47]British Thyroid Association. Guidelines for the management of thyroid cancer. July 2014 [internet publication].http://onlinelibrary.wiley.com/doi/10.1111/cen.12515/pdf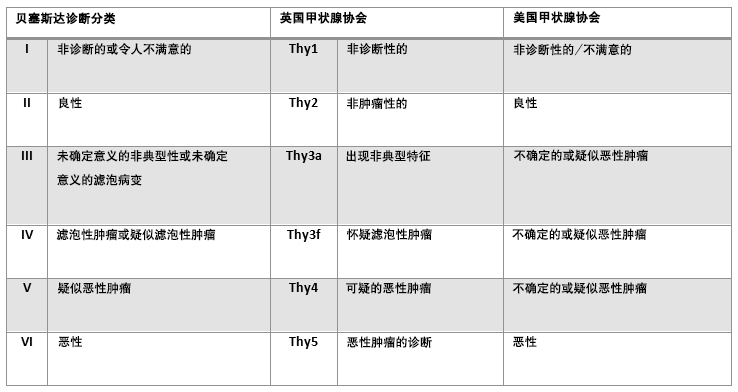 [Figure caption and citation for the preceding image starts]: 比较Bethesda分类系统及其他分类系统由 BMJ Knowledge Centre 编制 [Citation ends].
[Figure caption and citation for the preceding image starts]: 比较Bethesda分类系统及其他分类系统由 BMJ Knowledge Centre 编制 [Citation ends].
细针穿刺联合分子标志物
一些已经充分研究过的点突变与甲状腺癌有关,比如说BRAF V600E、NRAS61、HRAS61、KRAS12/13及RET/PTC和 PAX8/PPARγ重组。 用新兴的分子学检查辅助说明细针穿刺样本结果可提高细胞学诊断的准确性和阳性结果。 但这些技术在全球使用并不广泛,[48]Nikiforov YE, Nikiforova MN. Molecular genetics and diagnosis of thyroid cancer. Nat Rev Endocrinol. 2011 Aug 30;7(10):569-80.http://www.ncbi.nlm.nih.gov/pubmed/21878896?tool=bestpractice.com 如果可以应用,分子学检查对那些不能明确诊断、又伴有上述一个基因点突变或重组使恶性可能性显著增加的细胞标本将是一个很好的帮助。[43]Bumpous J, Celestre MD, Pribitkin E, et al. Decision making for diagnosis and management: algorithms from experts for molecular testing. Otolaryngol Clin North Am. 2014 Aug;47(4):609-23.http://www.ncbi.nlm.nih.gov/pubmed/25041961?tool=bestpractice.com[49]Nikiforov YE, Ohori NP, Hodak SP, et al. Impact of mutational testing on the diagnosis and management of patients with cytologically indeterminate thyroid nodules: a prospective analysis of 1056 FNA samples. J Clin Endocrinol Metab. 2011 Nov;96(11):3390-7.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3205883/http://www.ncbi.nlm.nih.gov/pubmed/21880806?tool=bestpractice.com 阳性分子检测的出现,则因此可能改变医学决策,有利于将早期甲状腺切除术作为初始外科处理最合适的选择。但是,由于30%的乳头瘤或滤泡癌不出现以上突变,因此不存在突变不能排除恶性的可能。如果无法做分子学检测,则有必要采用标准的诊断方法,通常涉及到诊断性腺叶切除(偏侧甲状腺切除术),以此来解决细胞学上模棱两可或不能确诊的病例。如果结果显示为癌症,则腺叶切除术可能足以治疗直径最大为 4 cm 的乳头状癌。[5]Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4739132/http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com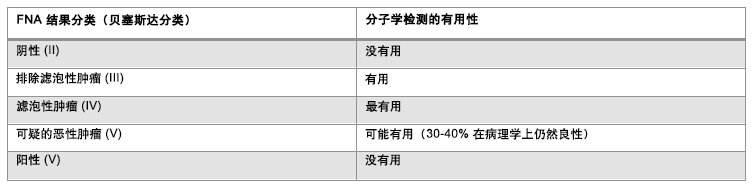 [Figure caption and citation for the preceding image starts]: 细针穿刺 (FNA) Bethesda 分类系统与当前可用分子标志物检测的实用性比较由 BMJ 知识中心编制;改编自 Bumpous J, Celestre MD, Pribitkin E, et al.Decision making for diagnosis and management: algorithms from experts for molecular testing.Otolaryngol Clin North Am.2014 Aug;47(4):609-23 [Citation ends].
[Figure caption and citation for the preceding image starts]: 细针穿刺 (FNA) Bethesda 分类系统与当前可用分子标志物检测的实用性比较由 BMJ 知识中心编制;改编自 Bumpous J, Celestre MD, Pribitkin E, et al.Decision making for diagnosis and management: algorithms from experts for molecular testing.Otolaryngol Clin North Am.2014 Aug;47(4):609-23 [Citation ends].
手术治疗
在两次或多次细针穿刺 (Bethesda I) 活检均不满意或不确定后,应考虑诊断性腺叶切除术,以确定组织学诊断;与所有甲状腺结节患者的总体发生率相比,这些患者的恶性肿瘤发生率更高。根据病变大小、淋巴结肿大、术后放射性碘的预期需求和其他共存的结节性疾病,建议对一些细胞学结果为恶性的患者进行甲状腺全切术。[5]Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4739132/http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com 结节性质不明或者病理学可疑恶性建议由外科及内分泌专科医生做多学科会诊,以制定最佳的治疗方案。 当出现压迫症状如压迫到气管或食管时也建议切除结节。 CT,MRI和呼吸流速环测定对于评估压迫程度可能是有用的辅助方法。 ≥4cm的结节也建议切除,因为细针穿刺由于样本误差造成的假阴性率达13%。[28]McCoy KL, Jabbour N, Ogilvie JB, et al. The incidence of cancer and rate of false-negative cytology in thyroid nodules greater than or equal to 4 cm in size. Surgery. 2007 Dec;142(6):837-44.http://www.ncbi.nlm.nih.gov/pubmed/18063065?tool=bestpractice.com 然而,细针穿刺对大结节的评估依然有帮助,因为术前评估结节的良恶性,使得能够对手术范围进行最佳规划。
所有接受甲状腺手术的患者都应接受术前发声评估;建议对有术前发声异常的患者进行术前喉部检查。[5]Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4739132/http://www.ncbi.nlm.nih.gov/pubmed/26462967?tool=bestpractice.com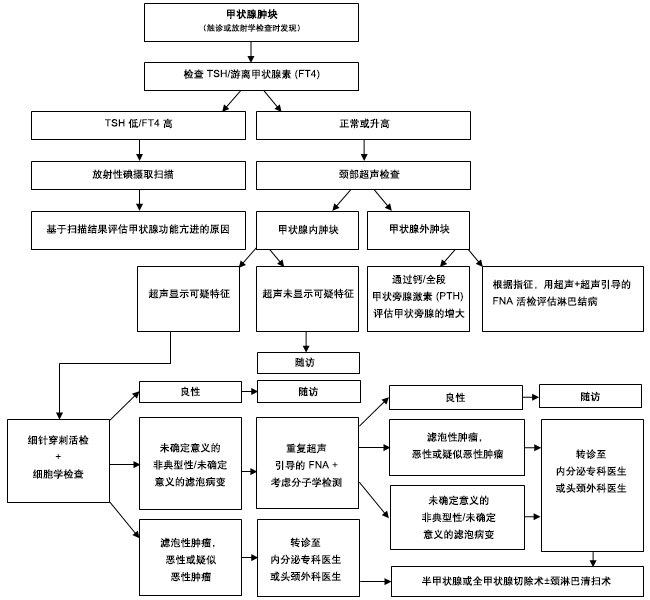 [Figure caption and citation for the preceding image starts]: 评估甲状腺肿物的方法由 BMJ 知识中心和 Dr B.C.Stack Jr 创建 [细针穿刺 (fine needle aspiration, FNA);甲状旁腺素 (parathyroid hormone, PTH);促甲状腺激素 (thyroid-stimulating hormone, TSH)] [Citation ends].
[Figure caption and citation for the preceding image starts]: 评估甲状腺肿物的方法由 BMJ 知识中心和 Dr B.C.Stack Jr 创建 [细针穿刺 (fine needle aspiration, FNA);甲状旁腺素 (parathyroid hormone, PTH);促甲状腺激素 (thyroid-stimulating hormone, TSH)] [Citation ends].
 [Figure caption and citation for the preceding image starts]: 结节的超声特征和细针穿刺的结节大小阈值由 BMJ 知识中心和 Dr B.C.Stack Jr 编制;改编自 Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133 [Citation ends].
[Figure caption and citation for the preceding image starts]: 结节的超声特征和细针穿刺的结节大小阈值由 BMJ 知识中心和 Dr B.C.Stack Jr 编制;改编自 Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2016 Jan;26(1):1-133 [Citation ends]. [Figure caption and citation for the preceding image starts]: Bethesda 系统用于甲状腺细胞病理学报告:推荐诊断分类、提示恶性风险和推荐的临床治疗。风险百分比取决于当地病理学家报告的异型性,和滤泡性病变的比率。对于外科医生来说,充分理解病理学家所报告各种 Bethesda 分类甲状腺结节的分级及其原理。处理可能取决于许多因素,例如结节大小、伴随症状、患者焦虑情绪以及细针穿刺 (FNA) 解读结果由 BMJ 知识中心编制;改编自 Bumpous J, Celestre MD, Pribitkin E, et al.Decision making for diagnosis and management: algorithms from experts for molecular testing.Otolaryngol Clin North Am.2014 Aug;47(4):609-23 [Citation ends].
[Figure caption and citation for the preceding image starts]: Bethesda 系统用于甲状腺细胞病理学报告:推荐诊断分类、提示恶性风险和推荐的临床治疗。风险百分比取决于当地病理学家报告的异型性,和滤泡性病变的比率。对于外科医生来说,充分理解病理学家所报告各种 Bethesda 分类甲状腺结节的分级及其原理。处理可能取决于许多因素,例如结节大小、伴随症状、患者焦虑情绪以及细针穿刺 (FNA) 解读结果由 BMJ 知识中心编制;改编自 Bumpous J, Celestre MD, Pribitkin E, et al.Decision making for diagnosis and management: algorithms from experts for molecular testing.Otolaryngol Clin North Am.2014 Aug;47(4):609-23 [Citation ends]. [Figure caption and citation for the preceding image starts]: 比较Bethesda分类系统及其他分类系统由 BMJ Knowledge Centre 编制 [Citation ends].
[Figure caption and citation for the preceding image starts]: 比较Bethesda分类系统及其他分类系统由 BMJ Knowledge Centre 编制 [Citation ends]. [Figure caption and citation for the preceding image starts]: 细针穿刺 (FNA) Bethesda 分类系统与当前可用分子标志物检测的实用性比较由 BMJ 知识中心编制;改编自 Bumpous J, Celestre MD, Pribitkin E, et al.Decision making for diagnosis and management: algorithms from experts for molecular testing.Otolaryngol Clin North Am.2014 Aug;47(4):609-23 [Citation ends].
[Figure caption and citation for the preceding image starts]: 细针穿刺 (FNA) Bethesda 分类系统与当前可用分子标志物检测的实用性比较由 BMJ 知识中心编制;改编自 Bumpous J, Celestre MD, Pribitkin E, et al.Decision making for diagnosis and management: algorithms from experts for molecular testing.Otolaryngol Clin North Am.2014 Aug;47(4):609-23 [Citation ends]. [Figure caption and citation for the preceding image starts]: 评估甲状腺肿物的方法由 BMJ 知识中心和 Dr B.C.Stack Jr 创建 [细针穿刺 (fine needle aspiration, FNA);甲状旁腺素 (parathyroid hormone, PTH);促甲状腺激素 (thyroid-stimulating hormone, TSH)] [Citation ends].
[Figure caption and citation for the preceding image starts]: 评估甲状腺肿物的方法由 BMJ 知识中心和 Dr B.C.Stack Jr 创建 [细针穿刺 (fine needle aspiration, FNA);甲状旁腺素 (parathyroid hormone, PTH);促甲状腺激素 (thyroid-stimulating hormone, TSH)] [Citation ends].