病史和查体
关键诊断因素
存在的危险因素
关键危险因素包括使用酒精、烟草或槟榔、慢性念珠菌病、免疫抑制和一些遗传疾病。
均质型白斑
主要发生在舌侧边缘、口底以及颊唇颊黏膜处。磨牙后区较少见。 [Figure caption and citation for the preceding image starts]: 均质型白斑承蒙 James Sciubba 医生提供;准许使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: 均质型白斑承蒙 James Sciubba 医生提供;准许使用 [Citation ends].
排除引起白色病变的其他病因
诊断为口腔白斑病必须排除局部刺激因素、感染、肿瘤和皮肤黏膜疾病。
非均质型白斑
颗粒型白斑具有沟裂状外观,红色(萎缩)区域不规则地散布在角化或白色斑点之间。 [Figure caption and citation for the preceding image starts]: 颗粒状白斑承蒙 James Sciubba 医生提供;准许使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: 颗粒状白斑承蒙 James Sciubba 医生提供;准许使用 [Citation ends].
结节型白斑表现为密集的半球状或瘤样小突起,病损表面发红或发白,基底可发红。
舌下白斑(舌下角化症)的特征性表现是位于舌腹部的大面积光滑或非均质性斑块。这类型的白斑异常增生程度和恶变几率较高,一些研究认为接近 1/2 的病例可能发生恶变,[110]但是也有人报道的恶变率低于上述水平。[111] [Figure caption and citation for the preceding image starts]: 舌下白斑承蒙 James Sciubba 医生提供;准许使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: 舌下白斑承蒙 James Sciubba 医生提供;准许使用 [Citation ends].
增殖性疣状白斑是一种渐进性角化病,病损呈疣状,常为多灶性。这是最少见口腔白斑类型,但易发生渐进性异常增生和恶变。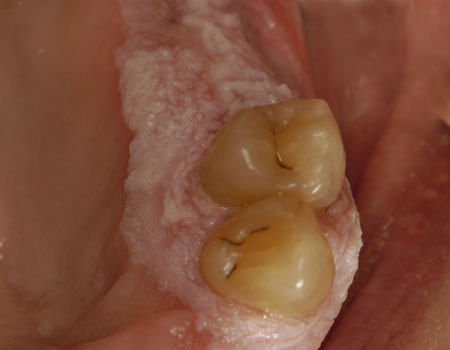 [Figure caption and citation for the preceding image starts]: 增殖性疣状白斑承蒙 James Sciubba 医生提供;准许使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: 增殖性疣状白斑承蒙 James Sciubba 医生提供;准许使用 [Citation ends].
其他诊断因素
危险因素
烟草使用
饮酒
咀嚼槟榔
目前,单纯使用槟榔叶在白斑发病中的实质性作用尚未得到确认,但槟榔咀嚼物中各种组分的共同作用可能与白斑有关。槟榔咀嚼物由槟榔叶包裹槟榔子、香料、熟石灰和树脂而成。咀嚼物中也可加入烟草。
当槟榔咀嚼物中不含烟草时,咀嚼物的使用频率和持续时间与口腔黏膜癌前病变(包括白斑)之间存在直接的量效关系。[25]咀嚼槟榔者中,吸烟人群的白斑的年发病率高于不吸烟人群。[26]
在不添加烟草的情况下,以薄片、条状、碾碎的粉末等形式加入的槟榔子在口腔黏膜癌前病变和口腔癌的发病中发挥重要作用。[27]
研究发现,槟榔咀嚼相关的口腔黏膜癌前病变的发病与频繁出现的 p14、p15、p16 超甲基化相关(这类变化不依赖于 p53 突变和表皮生长因子受体突变(外显子 7 的 Q787Q 突变))。[28][29]
慢性念珠菌病
遗传易感性
具有某些变异单倍型的人群更易患白斑和口腔癌:如 XRCC1 和 GSTM3 基因某些位点的变异。[34]线粒体多态性也可能发挥了重要作用。
免疫抑制
先天性角化不良(Zinsser-Cole-Engman 综合征)
是一种罕见的先天性遗传病,主要表现为角蛋白合成和角质形成细胞生物学行为的异常。遗传方式可为 X 连锁隐性遗传、常染色体显性遗传及常染色体隐性遗传。可影响多个系统,如皮肤、黏膜、骨髓、免疫系统等,引发包括再生障碍性贫血、血小板减少症、免疫缺陷和指(趾)甲萎缩在内的多种疾病。[37]
口腔白斑出现之前会有疱样病损,病损可发展为萎缩性病损,许多病例会在随后发展为上皮异常增生和鳞状细胞癌。
范可尼贫血
日光暴露
人乳头瘤病毒(human papilloma virus, HPV)感染
梅毒螺旋体感染(梅毒)
使用此内容应接受我们的免责声明。
