罹患静脉血栓栓塞 (VTE) 的风险增加。[76]Rosendaal FR, van Hylckama Vlieg A, Tanis BC, et al. Estrogens, progestogens and thrombosis. J Thromb Haemost. 2003;1:1371-1380.http://www.ncbi.nlm.nih.gov/pubmed/12871270?tool=bestpractice.com[77]Cosman F, Lindsay R. Selective estrogen receptor modulators: clinical spectrum. Endocr Rev. 1999;20:418-434.http://press.endocrine.org/doi/full/10.1210/edrv.20.3.0371http://www.ncbi.nlm.nih.gov/pubmed/10368777?tool=bestpractice.com
无个人/家族静脉血栓形成史的年轻女性服用口服避孕药的罹患静脉血栓栓塞的绝对风险仍然较低。
口服避孕药和激素替代治疗可以导致蛋白 S 水平减少,凝血因子 VII 和 VIII 的水平增加,纤维蛋白溶解增加,以及活化的蛋白C抵抗。[78]Vandenbroucke JP, Rosing J, Bloemenkamp KW, et al. Oral contraceptives and the risk of venous thrombosis. N Engl J Med. 2001;344:1527-1535.http://www.ncbi.nlm.nih.gov/pubmed/11357157?tool=bestpractice.com[80]Cosman F, Baz-Hecht M, Cushman M, et al. Short-term effects of estrogen, tamoxifen and raloxifene on hemostasis: a randomized-controlled study and review of the literature. Thromb Res. 2005;116:1-13.http://www.ncbi.nlm.nih.gov/pubmed/15850603?tool=bestpractice.com[81]Eilertsen AL, Sandvik L, Mowinckel MC, et al. Differential effects of conventional and low dose oral hormone therapy (HT), tibolone, and raloxifene on coagulation and fibrinolysis. Thromb Res. 2007;120:371-379.http://www.ncbi.nlm.nih.gov/pubmed/17156824?tool=bestpractice.com[82]van Baal WM, Emeis JJ, van der Mooren MJ, et al. Impaired procoagulant-anticoagulant balance during hormone replacement therapy? A randomised, placebo-controlled 12-week study. Thromb Haemost. 2000;83:29-34.http://www.ncbi.nlm.nih.gov/pubmed/10669150?tool=bestpractice.com
[76]Rosendaal FR, van Hylckama Vlieg A, Tanis BC, et al. Estrogens, progestogens and thrombosis. J Thromb Haemost. 2003;1:1371-1380.http://www.ncbi.nlm.nih.gov/pubmed/12871270?tool=bestpractice.com经皮激素替代治疗制剂可能比口服配方的风险低。
口服避孕药或者激素替代治疗开始后的第一个 12月内,静脉血栓栓塞的发生率最高。[76]Rosendaal FR, van Hylckama Vlieg A, Tanis BC, et al. Estrogens, progestogens and thrombosis. J Thromb Haemost. 2003;1:1371-1380.http://www.ncbi.nlm.nih.gov/pubmed/12871270?tool=bestpractice.com
选择性雌激素受体调节剂治疗(如他莫昔芬、雷洛昔芬)增加凝血因子 VIII 和 IX 及血管性血友病因子,减少蛋白C和抗凝血酶的水平。[80]Cosman F, Baz-Hecht M, Cushman M, et al. Short-term effects of estrogen, tamoxifen and raloxifene on hemostasis: a randomized-controlled study and review of the literature. Thromb Res. 2005;116:1-13.http://www.ncbi.nlm.nih.gov/pubmed/15850603?tool=bestpractice.com[81]Eilertsen AL, Sandvik L, Mowinckel MC, et al. Differential effects of conventional and low dose oral hormone therapy (HT), tibolone, and raloxifene on coagulation and fibrinolysis. Thromb Res. 2007;120:371-379.http://www.ncbi.nlm.nih.gov/pubmed/17156824?tool=bestpractice.com
他莫昔芬和雷洛昔芬与罹患静脉血栓栓塞风险增加 2-3 倍相关,尤其是对于具有基础遗传易栓性的患者,比如凝血因子 V Leiden。
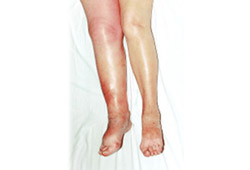 [Figure caption and citation for the preceding image starts]: 急性深静脉血栓形成由 Roopen Arya 博士提供,经许可后使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: 急性深静脉血栓形成由 Roopen Arya 博士提供,经许可后使用 [Citation ends].