食管癌通常很晚才表现出症状,这在一定程度上预示了一般预后不良。临床医生必须保持警惕性,为了在最早的时间做出诊断需行彻底的检查。食管癌的重要危险因素包括男性、吸烟、酗酒、GORD和巴雷特食管、食管、胃、口腔或咽部癌症家族史、低社会经济地位以及低新鲜水果和蔬菜摄入。
临床特点
食管鳞癌或局部晚期腺癌的最常见症状是吞咽困难和吞咽痛。对于巴雷特食管和食管及胃食管连接部的早期腺癌患者来说,反流是最常见的体征。严重的体重减轻通常在吞咽困难开始后出现。[33]Ebright M, Krasna M. Overview: esophageal and proximal stomach malignancy. In: Sugarbaker DJ, ed. Adult chest surgery: concepts and procedures. New York, NY: McGraw-Hill; 2009:chapter 10.
上段食管肿瘤可累及喉返神经,引起患者声音嘶哑。膈神经受累可引起打嗝。餐后或阵发性咳嗽可能表示存在因为肿瘤局部浸润而引发的食管-气管或者食管-支气管瘘。
检查
如果怀疑食管癌,第一项检查通常是上消化道内镜检查。 [Figure caption and citation for the preceding image starts]: 内镜下食管癌图Mark J. Krasna的个人收藏 [Citation ends].
[Figure caption and citation for the preceding image starts]: 内镜下食管癌图Mark J. Krasna的个人收藏 [Citation ends]. [Figure caption and citation for the preceding image starts]: 上消化道内镜见食管癌相关瘘(箭头所示)Wang S-C, Tseng J-C, Lee R-M, et al. Tracheo-oesophageal fistula in a patient with oesophageal squamous cell carcinoma.BMJ Case Reports.2009; doi:10.1136/bcr.09.2008.0865 [Citation ends].其可对任何梗阻进行评估,并且可行活检证实黏膜病变的组织学。共焦激光内镜靶向活检可以提高监测组患者食管癌诊断率和减少黏膜活检的次数。[34]Dunbar KB, Okolo P 3rd, Montgomery E, et al. Confocal laser endomicroscopy in Barrett's esophagus and endoscopically inapparent Barrett's neoplasia: a prospective, randomized, double-blind, controlled, crossover trial. Gastrointest Endosc. 2009;70:645-654.http://www.ncbi.nlm.nih.gov/pubmed/19559419?tool=bestpractice.com[35]Curvers WL, Herrero LA, Wallace MB, et al. Endoscopic tri-modal imaging is more effective than standard endoscopy in identifying early-stage neoplasia in Barrett's esophagus. Gastroenterology. 2010;139:1106-1114.http://www.ncbi.nlm.nih.gov/pubmed/20600033?tool=bestpractice.com内镜检查可以识别梗阻症状的良性病因,同时可行食管扩张,立即减轻症状。有时会在内镜检查前行钡餐检查以明确有无梗阻,但是并非常规要求。
[Figure caption and citation for the preceding image starts]: 上消化道内镜见食管癌相关瘘(箭头所示)Wang S-C, Tseng J-C, Lee R-M, et al. Tracheo-oesophageal fistula in a patient with oesophageal squamous cell carcinoma.BMJ Case Reports.2009; doi:10.1136/bcr.09.2008.0865 [Citation ends].其可对任何梗阻进行评估,并且可行活检证实黏膜病变的组织学。共焦激光内镜靶向活检可以提高监测组患者食管癌诊断率和减少黏膜活检的次数。[34]Dunbar KB, Okolo P 3rd, Montgomery E, et al. Confocal laser endomicroscopy in Barrett's esophagus and endoscopically inapparent Barrett's neoplasia: a prospective, randomized, double-blind, controlled, crossover trial. Gastrointest Endosc. 2009;70:645-654.http://www.ncbi.nlm.nih.gov/pubmed/19559419?tool=bestpractice.com[35]Curvers WL, Herrero LA, Wallace MB, et al. Endoscopic tri-modal imaging is more effective than standard endoscopy in identifying early-stage neoplasia in Barrett's esophagus. Gastroenterology. 2010;139:1106-1114.http://www.ncbi.nlm.nih.gov/pubmed/20600033?tool=bestpractice.com内镜检查可以识别梗阻症状的良性病因,同时可行食管扩张,立即减轻症状。有时会在内镜检查前行钡餐检查以明确有无梗阻,但是并非常规要求。
几乎或完全食管梗阻的进展期患者需要行血清电解质和肾功能检查,因为这部分患者可能由于无法吞咽液体和自身高钾唾液引发重度体液丢失和低钾血症。
诊断/分期
如果高度怀疑食管癌或者黏膜活检确诊为食管癌需要行胸腹部CT扫描。在评估肿瘤体积和监测肿瘤对治疗的应答方面,CT扫描起着关键性的作用。 [Figure caption and citation for the preceding image starts]: CT示下肺静脉水平T3期肿瘤Mark J. Krasna的个人收藏 [Citation ends].CT可以明确肿瘤是否已发生区域淋巴结转移和/或侵犯相邻结构,同时可以显示有无远处转移。应口服和静脉应用显影剂以确保内腔具有最佳的不透明度且心脏、纵膈血管和肝脏清晰可见。无论何种程度的扩张,食管壁厚>5mm是不正常的。食管癌的2个关键预后因素是肿瘤浸润或穿透食管壁的深度(T期)以及是否存在内脏转移。T1 期和 T2 期病变通常显示食管肿物厚度在 5-15 mm 之间,T3 期病变显示厚度>15 mm。T4 期病变的 CT 结果显示存在相邻结构的浸润。[36]Lefor AT, Merino MM, Steinberg SM, et al. Computerized tomographic prediction of extraluminal spread and prognostic implications of lesion width in esophageal carcinoma. Cancer. 1988;62:1287-1292.http://www.ncbi.nlm.nih.gov/pubmed/3416270?tool=bestpractice.com偶尔通过食管和周围结构(例如气道或大血管)之间的“接触”怀疑是 T4 期。一般来说,与主动脉接触超过90°可怀疑T4期食管癌。肺和肝脏的内脏转移最为常见,最容易由 CT 发现。[36]Lefor AT, Merino MM, Steinberg SM, et al. Computerized tomographic prediction of extraluminal spread and prognostic implications of lesion width in esophageal carcinoma. Cancer. 1988;62:1287-1292.http://www.ncbi.nlm.nih.gov/pubmed/3416270?tool=bestpractice.com在一些国家,使用腹部超声代替 CT 来诊断肝或腹腔淋巴腺的转移。
[Figure caption and citation for the preceding image starts]: CT示下肺静脉水平T3期肿瘤Mark J. Krasna的个人收藏 [Citation ends].CT可以明确肿瘤是否已发生区域淋巴结转移和/或侵犯相邻结构,同时可以显示有无远处转移。应口服和静脉应用显影剂以确保内腔具有最佳的不透明度且心脏、纵膈血管和肝脏清晰可见。无论何种程度的扩张,食管壁厚>5mm是不正常的。食管癌的2个关键预后因素是肿瘤浸润或穿透食管壁的深度(T期)以及是否存在内脏转移。T1 期和 T2 期病变通常显示食管肿物厚度在 5-15 mm 之间,T3 期病变显示厚度>15 mm。T4 期病变的 CT 结果显示存在相邻结构的浸润。[36]Lefor AT, Merino MM, Steinberg SM, et al. Computerized tomographic prediction of extraluminal spread and prognostic implications of lesion width in esophageal carcinoma. Cancer. 1988;62:1287-1292.http://www.ncbi.nlm.nih.gov/pubmed/3416270?tool=bestpractice.com偶尔通过食管和周围结构(例如气道或大血管)之间的“接触”怀疑是 T4 期。一般来说,与主动脉接触超过90°可怀疑T4期食管癌。肺和肝脏的内脏转移最为常见,最容易由 CT 发现。[36]Lefor AT, Merino MM, Steinberg SM, et al. Computerized tomographic prediction of extraluminal spread and prognostic implications of lesion width in esophageal carcinoma. Cancer. 1988;62:1287-1292.http://www.ncbi.nlm.nih.gov/pubmed/3416270?tool=bestpractice.com在一些国家,使用腹部超声代替 CT 来诊断肝或腹腔淋巴腺的转移。
MRI可替代CT进行食管癌分期的检查。对于诊断远处转移具有高度的准确性,特别是肝和肾上腺的转移以及明确晚期局部转移(T4)。但是,对于明确早期浸润(T1-T3)可靠性不佳。MRI在预测纵膈浸润方面似乎很灵敏,在血管和充气的气管支气管中缺失的信号可以清晰的描绘肿瘤以及主动脉和气管支气管树之间的轮廓。CT、MRI扫描在明确局限于黏膜或黏膜下层的肿瘤时效果欠佳,同时倾向于对区域淋巴结转移分期较低。[37]Dave UR, Williams AD, Wilson JA, et al. Esophageal cancer staging with endoscopic MR imaging: pilot study. Radiology. 2004;230:281-286.http://www.ncbi.nlm.nih.gov/pubmed/14645876?tool=bestpractice.com
使用(18F)-氟-2-脱氧-D-葡萄糖正电子发射断层扫描(FDG-PET)可通过检测单独使用CT无法确定的远端转移性疾病来提高分期的准确性,并帮助患者选择手术时间。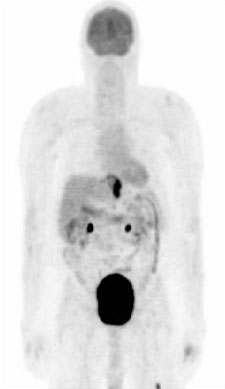 [Figure caption and citation for the preceding image starts]: PET示胃食管交界癌。注意左股骨转移性代谢灶Mark J. Krasna的个人收藏 [Citation ends].对于检测淋巴结和远端转移,PET比CT的灵敏度更高,对于确定是否可手术切除,PET比CT准确度好。但是小的区域淋巴结转移(<8mm)目前还不能被PET可靠地识别。[38]Wong R, Walker-Dilks C, Raifu A. Evidence-based guideline recommendations on the use of positron emission tomography imaging in oesophageal cancer. Clin Oncol (R Coll Radiol). 2012;24:86-104.http://www.ncbi.nlm.nih.gov/pubmed/21962904?tool=bestpractice.com另一个PET的潜在作用就是检测肿瘤对化疗和放疗的应答。[39]Kwee RM. Prediction of tumor response to neoadjuvant therapy in patients with esophageal cancer with use of 18F FDG PET: a systematic review. Radiology. 2010;254:707-717.http://www.ncbi.nlm.nih.gov/pubmed/20177086?tool=bestpractice.com[40]Rebollo Aguirre AC, Ramos-Font C, Villegas PR, et al. 18F-fluorodeoxiglucose positron emission tomography for the evaluation of neoadjuvant therapy response in esophageal cancer: systematic review of the literature. Ann Surg. 2009;250:247-254.http://www.ncbi.nlm.nih.gov/pubmed/19638908?tool=bestpractice.comFDG-PET成像可以识别葡萄糖摄取的改变,这可能是对于治疗有良好反应的一个更好的指标。已经证实PET有助于分类化疗反应和预测肺癌、头颈癌患者的生存期。[41]Javeri H, Xiao L, Rohren E, et al. The higher the decrease in the standardized uptake value of positron emission tomography after chemoradiation, the better the survival of patients with gastroesophageal adenocarcinoma. Cancer. 2009;115:5184-5192.http://www.ncbi.nlm.nih.gov/pubmed/19685531?tool=bestpractice.comMUNICON 2和即将公布的MUNICON 3试验结果应当明确PET在正在进行诱导治疗的食管癌患者重新分期当中的作用。[42]Lordick F. Optimizing neoadjuvant chemotherapy through the use of early response evaluation by positron emission tomography. Recent Results Cancer Res. 2012;196:201-211.http://www.ncbi.nlm.nih.gov/pubmed/23129376?tool=bestpractice.comFDG-PET扫描一般在EUS前检查,以对避免转移患者行不必要的检查。[43]Flamen P, Lerut A, Van Cutsem E, et al. Utility of positron emission tomography for the staging of patients with potentially operable esophageal carcinoma. J Clin Oncol. 2000;18:3202-3210.http://www.ncbi.nlm.nih.gov/pubmed/10986052?tool=bestpractice.comFDG 摄取的相对变化是新辅助治疗后的治疗反应和结果的有用指标。[44]Chen YM, Pan XF, Tong LJ, et al. Can 18F-fluorodeoxyglucose positron emission tomography predict responses to neoadjuvant therapy in oesophageal cancer patients? A meta-analysis. Nucl Med Commun. 2011;32:1005-1010.http://www.ncbi.nlm.nih.gov/pubmed/21886014?tool=bestpractice.com[45]Zhu W, Xing L, Yue J, et al. Prognostic significance of SUV on PET/CT in patients with localised oesophagogastric junction cancer receiving neoadjuvant chemotherapy/chemoradiation: a systematic review and meta-analysis. Br J Radiol. 2012;85:e694-e701.http://www.ncbi.nlm.nih.gov/pubmed/22337686?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: PET示胃食管交界癌。注意左股骨转移性代谢灶Mark J. Krasna的个人收藏 [Citation ends].对于检测淋巴结和远端转移,PET比CT的灵敏度更高,对于确定是否可手术切除,PET比CT准确度好。但是小的区域淋巴结转移(<8mm)目前还不能被PET可靠地识别。[38]Wong R, Walker-Dilks C, Raifu A. Evidence-based guideline recommendations on the use of positron emission tomography imaging in oesophageal cancer. Clin Oncol (R Coll Radiol). 2012;24:86-104.http://www.ncbi.nlm.nih.gov/pubmed/21962904?tool=bestpractice.com另一个PET的潜在作用就是检测肿瘤对化疗和放疗的应答。[39]Kwee RM. Prediction of tumor response to neoadjuvant therapy in patients with esophageal cancer with use of 18F FDG PET: a systematic review. Radiology. 2010;254:707-717.http://www.ncbi.nlm.nih.gov/pubmed/20177086?tool=bestpractice.com[40]Rebollo Aguirre AC, Ramos-Font C, Villegas PR, et al. 18F-fluorodeoxiglucose positron emission tomography for the evaluation of neoadjuvant therapy response in esophageal cancer: systematic review of the literature. Ann Surg. 2009;250:247-254.http://www.ncbi.nlm.nih.gov/pubmed/19638908?tool=bestpractice.comFDG-PET成像可以识别葡萄糖摄取的改变,这可能是对于治疗有良好反应的一个更好的指标。已经证实PET有助于分类化疗反应和预测肺癌、头颈癌患者的生存期。[41]Javeri H, Xiao L, Rohren E, et al. The higher the decrease in the standardized uptake value of positron emission tomography after chemoradiation, the better the survival of patients with gastroesophageal adenocarcinoma. Cancer. 2009;115:5184-5192.http://www.ncbi.nlm.nih.gov/pubmed/19685531?tool=bestpractice.comMUNICON 2和即将公布的MUNICON 3试验结果应当明确PET在正在进行诱导治疗的食管癌患者重新分期当中的作用。[42]Lordick F. Optimizing neoadjuvant chemotherapy through the use of early response evaluation by positron emission tomography. Recent Results Cancer Res. 2012;196:201-211.http://www.ncbi.nlm.nih.gov/pubmed/23129376?tool=bestpractice.comFDG-PET扫描一般在EUS前检查,以对避免转移患者行不必要的检查。[43]Flamen P, Lerut A, Van Cutsem E, et al. Utility of positron emission tomography for the staging of patients with potentially operable esophageal carcinoma. J Clin Oncol. 2000;18:3202-3210.http://www.ncbi.nlm.nih.gov/pubmed/10986052?tool=bestpractice.comFDG 摄取的相对变化是新辅助治疗后的治疗反应和结果的有用指标。[44]Chen YM, Pan XF, Tong LJ, et al. Can 18F-fluorodeoxyglucose positron emission tomography predict responses to neoadjuvant therapy in oesophageal cancer patients? A meta-analysis. Nucl Med Commun. 2011;32:1005-1010.http://www.ncbi.nlm.nih.gov/pubmed/21886014?tool=bestpractice.com[45]Zhu W, Xing L, Yue J, et al. Prognostic significance of SUV on PET/CT in patients with localised oesophagogastric junction cancer receiving neoadjuvant chemotherapy/chemoradiation: a systematic review and meta-analysis. Br J Radiol. 2012;85:e694-e701.http://www.ncbi.nlm.nih.gov/pubmed/22337686?tool=bestpractice.com
EUS是对食管癌进行分期的新方法之一,尽管狭窄可限制其使用。[46]Puli SR, Reddy JB, Bechtold ML, et al. Accuracy of endoscopic ultrasound in the diagnosis of distal and celiac axis lymph node metastasis in esophageal cancer: a meta-analysis and systematic review. Dig Dis Sci. 2008;53:2405-2414.http://www.ncbi.nlm.nih.gov/pubmed/18097752?tool=bestpractice.com此外,距离食管>2cm的远处淋巴结转移不能成像,因为超声的穿透深度很有限。但是,它可以帮助评估肿瘤能否被完全切除。不能被完全切除的情况包括:肿瘤侵入到左心房、降主动脉壁、脊髓、肺动静脉或者气管支气管系统。后者应由支气管镜下的细针穿刺活检确诊。 [Figure caption and citation for the preceding image starts]: 经支气管镜证实的气管浸润 (T4)Mark J. Krasna的个人收藏 [Citation ends].EUS目前已经成为食管癌患者的标准诊断检查,不应被遗漏,特别是在临床环境当中。
[Figure caption and citation for the preceding image starts]: 经支气管镜证实的气管浸润 (T4)Mark J. Krasna的个人收藏 [Citation ends].EUS目前已经成为食管癌患者的标准诊断检查,不应被遗漏,特别是在临床环境当中。
也可以通过超声内镜行超声引导下细针穿刺活检。 [Figure caption and citation for the preceding image starts]: 超声引导内镜下细针穿刺淋巴结活检Mark J. Krasna的个人收藏 [Citation ends].目前,EUS结合FNA(EUS/FNA)是进行食管癌局部分期的最准确的影像学方法。尽管 EUS 对未经治疗的食管癌再分期极为准确,但是其在新辅助放化疗后肿瘤分期中的准确度相对较差,大多数错误是由过度分期所致。但是 EUS 在预测治疗前初始 T 分期时的准确度接近 90%,如果在新辅助治疗后使用则准确度降低至 27%-82% 之间。新辅助治疗后 N 分期的准确度评估在 38%-73% 之间,预期 FNA 可进一步增加准确度。这些结果呈现明显的检查人员依赖性,随着经验的增加可明显提高准确性。治疗后分期的错误可能是由于纤维化和残余肿瘤有类似的回波现象。残余的结节状病灶是预后不良的表现。EUS/FNA 是检测淋巴结内残余癌的有效方法,将来在新辅助治疗后可选择进行切除术的患者中起到重要作用。[47]Boyce HW Jr. Endosonographic staging of esophageal cancer. Cancer Control. 1999;6:28-35.http://www.ncbi.nlm.nih.gov/pubmed/10758532?tool=bestpractice.com[48]Chang KJ, Katz KD, Durbin TE, et al. Endoscopic ultrasound-guided fine-needle aspiration. Gastrointest Endosc. 1994;40:694-699.http://www.ncbi.nlm.nih.gov/pubmed/7859967?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: 超声引导内镜下细针穿刺淋巴结活检Mark J. Krasna的个人收藏 [Citation ends].目前,EUS结合FNA(EUS/FNA)是进行食管癌局部分期的最准确的影像学方法。尽管 EUS 对未经治疗的食管癌再分期极为准确,但是其在新辅助放化疗后肿瘤分期中的准确度相对较差,大多数错误是由过度分期所致。但是 EUS 在预测治疗前初始 T 分期时的准确度接近 90%,如果在新辅助治疗后使用则准确度降低至 27%-82% 之间。新辅助治疗后 N 分期的准确度评估在 38%-73% 之间,预期 FNA 可进一步增加准确度。这些结果呈现明显的检查人员依赖性,随着经验的增加可明显提高准确性。治疗后分期的错误可能是由于纤维化和残余肿瘤有类似的回波现象。残余的结节状病灶是预后不良的表现。EUS/FNA 是检测淋巴结内残余癌的有效方法,将来在新辅助治疗后可选择进行切除术的患者中起到重要作用。[47]Boyce HW Jr. Endosonographic staging of esophageal cancer. Cancer Control. 1999;6:28-35.http://www.ncbi.nlm.nih.gov/pubmed/10758532?tool=bestpractice.com[48]Chang KJ, Katz KD, Durbin TE, et al. Endoscopic ultrasound-guided fine-needle aspiration. Gastrointest Endosc. 1994;40:694-699.http://www.ncbi.nlm.nih.gov/pubmed/7859967?tool=bestpractice.com
对中上段食管癌患者进行支气管镜下活检、FNA或者是刷片可以帮助明确有无气管支气管侵犯。FNA可深入管腔内黏膜病变位置或通过气管支气管进入与气道相邻的病变位置。 [Figure caption and citation for the preceding image starts]: 经支气管镜证实的气管浸润 (T4)Mark J. Krasna的个人收藏 [Citation ends].
[Figure caption and citation for the preceding image starts]: 经支气管镜证实的气管浸润 (T4)Mark J. Krasna的个人收藏 [Citation ends].
胸片在当今食管癌的诊断和分期中作用最小,尽管其可在几乎半数的食管癌患者身上发现异常现象。但是,在一些国家,胸片仍然作为识别由误吸和胸腔积液引起的肺门或纵膈腺体疾病、肺转移以及二次肺浸润的一种常规方法。
一般来说,如果患者有经EUS/FNA病理证实的淋巴结转移的证据,那么这被认为是明确的,应该行适当的分期治疗。
或者,如果EUS/FNA表明没有淋巴结转移,胸腔镜和腹腔镜仍然是明确分期的常用方法。该方法已被用来帮助治疗前患者进行准确分期。[49]Krasna MJ, Flowers JL, Attar S, et al. Combined thoracoscopic/laparoscopic staging of esophageal cancer. J Thorac Cardiovasc Surg. 1996;111:800-807.http://www.ncbi.nlm.nih.gov/pubmed/8614140?tool=bestpractice.com[50]Krasna MJ, Reed CE, Niedzwiecki D, et al. CALGB 9380: a prospective trial of the feasibility of thoracoscopy/laparoscopy in staging esophageal cancer. Ann Thorac Surg. 2001;71:1073-1079.http://www.ncbi.nlm.nih.gov/pubmed/11308139?tool=bestpractice.com一项研究表明,在369例食管癌患者中行常规腹腔镜检查可见14%有腹腔转移,9.7%有腹腔淋巴结转移。[51]Dagnini G, Caldironi MW, Marin G, et al. Laparoscopy in abdominal staging of esophageal carcinoma: report of 369 cases. Gastrointest Endosc. 1986;32:400-402.http://www.ncbi.nlm.nih.gov/pubmed/2948863?tool=bestpractice.com腹腔镜结合腹腔镜超声和腹腔灌洗对于确定淋巴结转移的灵敏度为67%,特异度为92%。CT、MRI和EUS可以指导外科医生聚焦于可疑区域以获得最佳结果。这种方法在评估局部和腹腔淋巴转移方面具有更高的准确度。[52]Chang L, Stefanidis D, Richardson WS, et al. The role of staging laparoscopy for intraabdominal cancers: an evidence-based review. Surg Endosc. 2009;23:231-241.http://www.ncbi.nlm.nih.gov/pubmed/18813972?tool=bestpractice.com一些学者提倡对食管和胃腺癌的患者常规行腹腔镜腹膜灌洗和细胞学检查。[53]Mezhir JJ, Shah MA, Jacks LM, et al. Positive peritoneal cytology in patients with gastric cancer: natural history and outcome of 291 patients. Ann Surg Oncol. 2010;17:3173-3180.http://www.ncbi.nlm.nih.gov/pubmed/20585870?tool=bestpractice.com
这些信息在对患者进行分层和选择治疗方案方面非常重要,特别是在制定新的治疗方案时。此外,纵膈和腹腔淋巴结病理类型是决定放疗范围的关键因素。这可使患病区域接受最大剂量的辐射,但对周围正常敏感的组织的辐射则最小。
分期
全球食管癌协作组织(WECC)癌症分期(新美国癌症联合委员会[AJCC]系统)[54]Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol. 2010;17:1471-1474.http://www.ncbi.nlm.nih.gov/pubmed/20180029?tool=bestpractice.com[55]Sobin LH, Gospodarowicz MK, Wittekind C, eds. TNM classification of malignant tumours. 7th ed. Oxford, UK: Wiley-Blackwell; 2009.[56]Ishwaran H, Blackstone EH, Apperson-Hansen C, et al. A novel approach to cancer staging: application to esophageal cancer. Biostatistics. 2009;10:603-620.http://www.ncbi.nlm.nih.gov/pubmed/19502615?tool=bestpractice.com[57]Rice TW, Rusch VW, Apperson-Hansen C, et al. Worldwide esophageal cancer collaboration. Dis Esophagus. 2009;22:1-8.http://www.ncbi.nlm.nih.gov/pubmed/19196264?tool=bestpractice.com[58]Rizk NP, Ishwaran H, Rice TW, et al. Optimum lymphadenectomy for esophageal cancer. Ann Surg. 2010;251:46-50.http://www.ncbi.nlm.nih.gov/pubmed/20032718?tool=bestpractice.com
TNM分类
分化程度
Gx:无法评估级别
G1:高分化
G2:中分化
G3:低分化
G4:未分化
原发肿瘤(T)
TX:原发肿瘤不能评估
T0:无原发肿瘤证据
Tis:重度不典型增生
T1a:肿瘤侵及黏膜固有层或黏膜肌层
T1b:肿瘤侵及黏膜下层
T2:肿瘤侵及固有肌层
T3:肿瘤侵及食管纤维膜
T4a:肿瘤侵及胸膜、心包或膈肌
T4b:肿瘤侵及其他邻近结构
区域淋巴结(N)
Nx:区域淋巴结无法评估
N0:无区域淋巴结转移
N1:1-2个区域淋巴结转移*
N2:3-6个区域淋巴结转移*
N3:≥7个区域淋巴结转移*
*区域淋巴结指从颈部食管周围延伸至腹腔淋巴结
远处转移(M)
MX:远处转移无法评估
M0:无远处转移
M1:有远处或非区域淋巴结转移
分期
0期:T0N0M0,任何G;TisN0M0,任何G
IA期:T1N0M0,G1-2
IB期:T1N0M0,G3;T1N0M0,G4;T2N0M0,G1-2
IIA期:T2N0M0,G3-4
IIB期:T3N0M0;T0N1M0,任何G;T1-2N1M0,任何G
IIB期:T3N0M0;T0N1M0,任何G;T1-2N1M0,任何G
IIIB:T3N2M0,任何G
IIIC期:T4aN1-2M0,任何G;T4b任何N M0,任何G;任何T N3M0,任何G
IV期:任何T 任何N M1,任何G
术前评估
食管癌需要结合手术、化疗和放疗进行强化治疗;然而,很多患者处于肿瘤晚期并存在并发症,这可能影响这种治疗方法的适用性。肺功能检查(PFTs)是决定患者是否有能力承受这种综合治疗的检查。肺功能检查差的患者使用微创治疗方法,这是一种非开胸的颈胸联合(经膈肌)的食管切除术,可以降低发病率和死亡率。心脏负荷试验和心脏彩超可以评估心脏风险。
 [Figure caption and citation for the preceding image starts]: 内镜下食管癌图Mark J. Krasna的个人收藏 [Citation ends].
[Figure caption and citation for the preceding image starts]: 内镜下食管癌图Mark J. Krasna的个人收藏 [Citation ends]. [Figure caption and citation for the preceding image starts]: 上消化道内镜见食管癌相关瘘(箭头所示)Wang S-C, Tseng J-C, Lee R-M, et al. Tracheo-oesophageal fistula in a patient with oesophageal squamous cell carcinoma.BMJ Case Reports.2009; doi:10.1136/bcr.09.2008.0865 [Citation ends].其可对任何梗阻进行评估,并且可行活检证实黏膜病变的组织学。共焦激光内镜靶向活检可以提高监测组患者食管癌诊断率和减少黏膜活检的次数。[34][35]内镜检查可以识别梗阻症状的良性病因,同时可行食管扩张,立即减轻症状。有时会在内镜检查前行钡餐检查以明确有无梗阻,但是并非常规要求。
[Figure caption and citation for the preceding image starts]: 上消化道内镜见食管癌相关瘘(箭头所示)Wang S-C, Tseng J-C, Lee R-M, et al. Tracheo-oesophageal fistula in a patient with oesophageal squamous cell carcinoma.BMJ Case Reports.2009; doi:10.1136/bcr.09.2008.0865 [Citation ends].其可对任何梗阻进行评估,并且可行活检证实黏膜病变的组织学。共焦激光内镜靶向活检可以提高监测组患者食管癌诊断率和减少黏膜活检的次数。[34][35]内镜检查可以识别梗阻症状的良性病因,同时可行食管扩张,立即减轻症状。有时会在内镜检查前行钡餐检查以明确有无梗阻,但是并非常规要求。 [Figure caption and citation for the preceding image starts]: CT示下肺静脉水平T3期肿瘤Mark J. Krasna的个人收藏 [Citation ends].CT可以明确肿瘤是否已发生区域淋巴结转移和/或侵犯相邻结构,同时可以显示有无远处转移。应口服和静脉应用显影剂以确保内腔具有最佳的不透明度且心脏、纵膈血管和肝脏清晰可见。无论何种程度的扩张,食管壁厚>5mm是不正常的。食管癌的2个关键预后因素是肿瘤浸润或穿透食管壁的深度(T期)以及是否存在内脏转移。T1 期和 T2 期病变通常显示食管肿物厚度在 5-15 mm 之间,T3 期病变显示厚度>15 mm。T4 期病变的 CT 结果显示存在相邻结构的浸润。[36]偶尔通过食管和周围结构(例如气道或大血管)之间的“接触”怀疑是 T4 期。一般来说,与主动脉接触超过90°可怀疑T4期食管癌。肺和肝脏的内脏转移最为常见,最容易由 CT 发现。[36]在一些国家,使用腹部超声代替 CT 来诊断肝或腹腔淋巴腺的转移。
[Figure caption and citation for the preceding image starts]: CT示下肺静脉水平T3期肿瘤Mark J. Krasna的个人收藏 [Citation ends].CT可以明确肿瘤是否已发生区域淋巴结转移和/或侵犯相邻结构,同时可以显示有无远处转移。应口服和静脉应用显影剂以确保内腔具有最佳的不透明度且心脏、纵膈血管和肝脏清晰可见。无论何种程度的扩张,食管壁厚>5mm是不正常的。食管癌的2个关键预后因素是肿瘤浸润或穿透食管壁的深度(T期)以及是否存在内脏转移。T1 期和 T2 期病变通常显示食管肿物厚度在 5-15 mm 之间,T3 期病变显示厚度>15 mm。T4 期病变的 CT 结果显示存在相邻结构的浸润。[36]偶尔通过食管和周围结构(例如气道或大血管)之间的“接触”怀疑是 T4 期。一般来说,与主动脉接触超过90°可怀疑T4期食管癌。肺和肝脏的内脏转移最为常见,最容易由 CT 发现。[36]在一些国家,使用腹部超声代替 CT 来诊断肝或腹腔淋巴腺的转移。 [Figure caption and citation for the preceding image starts]: PET示胃食管交界癌。注意左股骨转移性代谢灶Mark J. Krasna的个人收藏 [Citation ends].对于检测淋巴结和远端转移,PET比CT的灵敏度更高,对于确定是否可手术切除,PET比CT准确度好。但是小的区域淋巴结转移(<8mm)目前还不能被PET可靠地识别。[38]另一个PET的潜在作用就是检测肿瘤对化疗和放疗的应答。[39][40]FDG-PET成像可以识别葡萄糖摄取的改变,这可能是对于治疗有良好反应的一个更好的指标。已经证实PET有助于分类化疗反应和预测肺癌、头颈癌患者的生存期。[41]MUNICON 2和即将公布的MUNICON 3试验结果应当明确PET在正在进行诱导治疗的食管癌患者重新分期当中的作用。[42]FDG-PET扫描一般在EUS前检查,以对避免转移患者行不必要的检查。[43]FDG 摄取的相对变化是新辅助治疗后的治疗反应和结果的有用指标。[44][45]
[Figure caption and citation for the preceding image starts]: PET示胃食管交界癌。注意左股骨转移性代谢灶Mark J. Krasna的个人收藏 [Citation ends].对于检测淋巴结和远端转移,PET比CT的灵敏度更高,对于确定是否可手术切除,PET比CT准确度好。但是小的区域淋巴结转移(<8mm)目前还不能被PET可靠地识别。[38]另一个PET的潜在作用就是检测肿瘤对化疗和放疗的应答。[39][40]FDG-PET成像可以识别葡萄糖摄取的改变,这可能是对于治疗有良好反应的一个更好的指标。已经证实PET有助于分类化疗反应和预测肺癌、头颈癌患者的生存期。[41]MUNICON 2和即将公布的MUNICON 3试验结果应当明确PET在正在进行诱导治疗的食管癌患者重新分期当中的作用。[42]FDG-PET扫描一般在EUS前检查,以对避免转移患者行不必要的检查。[43]FDG 摄取的相对变化是新辅助治疗后的治疗反应和结果的有用指标。[44][45] [Figure caption and citation for the preceding image starts]: 经支气管镜证实的气管浸润 (T4)Mark J. Krasna的个人收藏 [Citation ends].EUS目前已经成为食管癌患者的标准诊断检查,不应被遗漏,特别是在临床环境当中。
[Figure caption and citation for the preceding image starts]: 经支气管镜证实的气管浸润 (T4)Mark J. Krasna的个人收藏 [Citation ends].EUS目前已经成为食管癌患者的标准诊断检查,不应被遗漏,特别是在临床环境当中。 [Figure caption and citation for the preceding image starts]: 超声引导内镜下细针穿刺淋巴结活检Mark J. Krasna的个人收藏 [Citation ends].目前,EUS结合FNA(EUS/FNA)是进行食管癌局部分期的最准确的影像学方法。尽管 EUS 对未经治疗的食管癌再分期极为准确,但是其在新辅助放化疗后肿瘤分期中的准确度相对较差,大多数错误是由过度分期所致。但是 EUS 在预测治疗前初始 T 分期时的准确度接近 90%,如果在新辅助治疗后使用则准确度降低至 27%-82% 之间。新辅助治疗后 N 分期的准确度评估在 38%-73% 之间,预期 FNA 可进一步增加准确度。这些结果呈现明显的检查人员依赖性,随着经验的增加可明显提高准确性。治疗后分期的错误可能是由于纤维化和残余肿瘤有类似的回波现象。残余的结节状病灶是预后不良的表现。EUS/FNA 是检测淋巴结内残余癌的有效方法,将来在新辅助治疗后可选择进行切除术的患者中起到重要作用。[47][48]
[Figure caption and citation for the preceding image starts]: 超声引导内镜下细针穿刺淋巴结活检Mark J. Krasna的个人收藏 [Citation ends].目前,EUS结合FNA(EUS/FNA)是进行食管癌局部分期的最准确的影像学方法。尽管 EUS 对未经治疗的食管癌再分期极为准确,但是其在新辅助放化疗后肿瘤分期中的准确度相对较差,大多数错误是由过度分期所致。但是 EUS 在预测治疗前初始 T 分期时的准确度接近 90%,如果在新辅助治疗后使用则准确度降低至 27%-82% 之间。新辅助治疗后 N 分期的准确度评估在 38%-73% 之间,预期 FNA 可进一步增加准确度。这些结果呈现明显的检查人员依赖性,随着经验的增加可明显提高准确性。治疗后分期的错误可能是由于纤维化和残余肿瘤有类似的回波现象。残余的结节状病灶是预后不良的表现。EUS/FNA 是检测淋巴结内残余癌的有效方法,将来在新辅助治疗后可选择进行切除术的患者中起到重要作用。[47][48] [Figure caption and citation for the preceding image starts]: 经支气管镜证实的气管浸润 (T4)Mark J. Krasna的个人收藏 [Citation ends].
[Figure caption and citation for the preceding image starts]: 经支气管镜证实的气管浸润 (T4)Mark J. Krasna的个人收藏 [Citation ends].