初始治疗包括评估和管理患者的气道、呼吸和血液循环状况,同时还要防止热量进一步散失。 首先,必须让患者远离寒冷环境。 然后开始复温,脱去湿冷衣物并用加热毯覆盖患者。 使用太空加热毯有助于患者保暖。 需要密切监测体核温度以避免医源性高热。 复温期间,由于血管扩张会导致血管内腔扩大,因此患者需要补充大量体液。 持续血流动力学监测和静脉输注温液体是有必要的。 复温期间和复温后应避免发生体温过高。[24]European Resuscitation Council. The European Resuscitation Council Guidelines for Resuscitation 2015. Oct 2015 [internet publication].https://ercguidelines.elsevierresource.com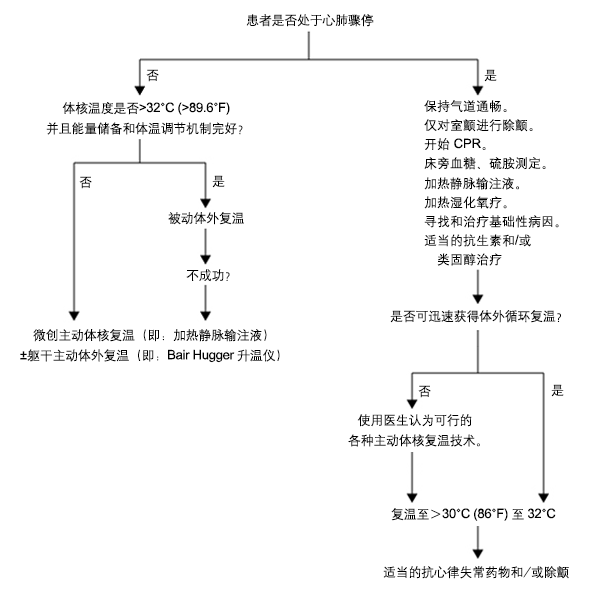 [Figure caption and citation for the preceding image starts]: 低体温患者治疗方法流程来源于:McCullough L, Arora S. Am Fam Physician. 2004;70:2325-2332;获准使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: 低体温患者治疗方法流程来源于:McCullough L, Arora S. Am Fam Physician. 2004;70:2325-2332;获准使用 [Citation ends].
低体温患者的院前急救
低体温患者的入院前管理应着重预防体温的进一步下降,根据基础生命支持 (BLS) 和高级生命支持 (ALS) 方案稳定患者病情,保持患者处于仰卧位,通过可用的体内和体外复温方法实现患者主动复温来稳定体核温度。由于心脏兴奋性使得患者容易发生心律失常,在移动患者的过程中,保持动作轻柔十分重要。为了预防周围血管扩张所致血压下降引起的致命性心律失常,不推荐将运动作为复温方法(除非体核温度高于 35°C [95°F]);运动还可导致低温血液回流至中央循环。[25]Weinberg AD. Hypothermia. Ann Emerg Med. 1993 Feb;22(2 Pt 2):370-77.http://www.ncbi.nlm.nih.gov/pubmed/8434836?tool=bestpractice.com
气道
除了体温下降程度极轻微的患者之外,都应进行早期气管插管以预防支气管痉挛。 必须避免支气管痉挛,因其可抑制心肌收缩性和恶化心律失常。
呼吸
在复温期间,患者应接受 40°C (104°F) 湿化氧疗。 在这一温度下,体核温度每小时会增加 1°C-2°C,呼吸期间蒸发丢失的热量也会减少。[26]Danzl DF, Pozos RS. Accidental hypothermia. N Engl J Med. 1994 Dec 29;331(26):1756-60.http://www.ncbi.nlm.nih.gov/pubmed/7984198?tool=bestpractice.com
循环
患者应静脉输注温热的晶体溶液。 有时对于难以容量复苏的患者可以使用多巴胺。[11]Jolly BT, Ghezzi KT. Accidental hypothermia. Emerg Med Clin North Am. 1992 May;10(2):311-27.http://www.ncbi.nlm.nih.gov/pubmed/1559471?tool=bestpractice.com 低温心脏可能对心血管药物、起搏器刺激和除颤治疗无反应。此外,药物代谢会减慢。如果患者的体温严重下降,反复应用作用于心脏的药物能达到毒性水平。因此,如果患者的体核温度<30°C (<86°F),经常需要暂停静脉给药。如果体核温度>30°C (>86°F),可以静脉给药,但应延长给药间隔(通常时间间隔加倍)。[27]American Heart Association. 2015 AMA guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation. 2015 Nov 3;132(18 Suppl 2):S315-573.http://circ.ahajournals.org/content/132/18_suppl_2[28]Truhlář A, Deakin CD, Soar J, et al; Cardiac arrest in special circumstances section Collaborators. European Resuscitation Council guidelines for resuscitation 2015: Section 4. Cardiac arrest in special circumstances. Resuscitation. 2015 Oct;95:148-201.http://ercguidelines.elsevierresource.com/european-resuscitation-council-guidelines-resuscitation-2015-section-4-cardiac-arrest-specialhttp://www.ncbi.nlm.nih.gov/pubmed/26477412?tool=bestpractice.com
复温
复温方法可以为主动或被动的体内或体外复温方法,如将温液体直接输入腹腔,体外复温方法如用加热隔热毯覆盖患者身体。[11]Jolly BT, Ghezzi KT. Accidental hypothermia. Emerg Med Clin North Am. 1992 May;10(2):311-27.http://www.ncbi.nlm.nih.gov/pubmed/1559471?tool=bestpractice.com 静脉输注的液体应加热至约 40°C-45°C (104°F-113°F)。[1]McCullough L, Arora S. Diagnosis and treatment of hypothermia. Am Fam Physician. 2004 Dec 15;70(12):2325-32.https://www.aafp.org/afp/2004/1215/p2325.htmlhttp://www.ncbi.nlm.nih.gov/pubmed/15617296?tool=bestpractice.com 输注加热后的静脉注射液还有另外一个优势,即增加药物的吸收。 最为重要的是,这些液体的温度不应低于患者的体核温度。
体外复温方法
被动体外复温是轻度低体温患者的首选治疗方法。 处理方法包括脱去浸湿衣物以及用加热毯覆盖患者。
主动体外复温与被动体外复温极其类似,适用于中度至重度低体温患者。 除了用加热毯覆盖患者之外,主动体外复温还包括让加压暖空气直接作用于患者身体。 Bair-Hµgger 加热器的应用就是主动体外复温的一个成功例子。
体内复温方法
应用主动体内复温,或单独使用主动体核复温,或主动核心复温联合主动体外复温是最积极的治疗策略,适用于中度至重度低体温患者。 有效的方法包括胸腔和腹腔灌注温盐水,持续动静脉或静脉-静脉血液透析复温。[13]Sterba JA. Efficacy and safety of prehospital rewarming techniques to treat accidental hypothermia. Ann Emerg Med. 1991 Aug;20(8):896-901.http://www.ncbi.nlm.nih.gov/pubmed/1854075?tool=bestpractice.com[26]Danzl DF, Pozos RS. Accidental hypothermia. N Engl J Med. 1994 Dec 29;331(26):1756-60.http://www.ncbi.nlm.nih.gov/pubmed/7984198?tool=bestpractice.com[29]Gentilello LM. Advances in the management of hypothermia. Surg Clin North Am. 1995 Apr;75(2):243-56.http://www.ncbi.nlm.nih.gov/pubmed/7899996?tool=bestpractice.com[30]Harnett RM, O'Brien EM, Sias FR, et al. Initial treatment of profound accidental hypothermia. Aviat Space Environ Med. 1980 Jul;51(7):680-87.http://www.ncbi.nlm.nih.gov/pubmed/7417132?tool=bestpractice.com[31]Vretenar DF, Urschel JD, Parrott JCW, et al. Cardiopulmonary bypass resuscitation for accidental hypothermia. Ann Thorac Surg. 1994 Sep;58(3):895-8.http://www.ncbi.nlm.nih.gov/pubmed/7944731?tool=bestpractice.com
对于存在意识改变的低体温患者,应送至能够进行主动体外和体内复温的医院。对于有呼吸暂停和心脏停搏的体温过低患者,体外循环复温是主动体内复温的首选方法,因为其在使体核温度增加 8°C-12°C (14°F-22°F) 的同时,还可以维持充分的血液循环和氧合。[24]European Resuscitation Council. The European Resuscitation Council Guidelines for Resuscitation 2015. Oct 2015 [internet publication].https://ercguidelines.elsevierresource.com 体外循环是主动复温的最佳方法,但体外循环需要进行肝素化,这对已有凝血功能异常风险的低体温患者是不利的。 目前研究正着眼于探索能够解决这一问题的方法。
一项回顾性研究显示,与其他主动的体内复温方法相比,体外循环血液加温能够使伴有心脏骤停的重度低体温患者的长期生存率提高47%。[32]Walpoth BH, Walpoth-Aslan BN, Mattle HP, et al. Outcome of survivors of accidental deep hypothermia and circulatory arrest treated with extracorporeal blood warming. N Engl J Med. 1997 Nov 20;337(21):1500-05.http://www.ncbi.nlm.nih.gov/pubmed/9366581?tool=bestpractice.com 虽然治疗组的患者相对年轻且既往身体状况良好,但这些患者的存活也可能与应用了体外循环有关,后者在实现快速核心复温的同时,还能提供充分的循环支持,这是其他复温方法达不到的。最新证据表明,采用体外循环的生存结局优于采用其他方法。体外循环复温可使体核温度每 3-5 分钟增加 1°C-2°C (1.8°F-3.6°F)。[26]Danzl DF, Pozos RS. Accidental hypothermia. N Engl J Med. 1994 Dec 29;331(26):1756-60.http://www.ncbi.nlm.nih.gov/pubmed/7984198?tool=bestpractice.com
 [Figure caption and citation for the preceding image starts]: 低体温患者治疗方法流程来源于:McCullough L, Arora S. Am Fam Physician. 2004;70:2325-2332;获准使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: 低体温患者治疗方法流程来源于:McCullough L, Arora S. Am Fam Physician. 2004;70:2325-2332;获准使用 [Citation ends].