病因学
胃酸缺乏的最常见病因是慢性萎缩性胃炎。胃萎缩可定义为胃底和胃体部的腺体(泌酸腺体)或者特定细胞壁细胞的减少或消失。胃萎缩的原因是幽门螺杆菌感染,主要是自身免疫性胃炎,以及幽门螺杆菌和自身免疫性胃炎的结合。[33]目前认为,胃萎缩(伴有或不伴有自身免疫性胃炎)主要是由幽门螺杆菌感染所引发。[34][35][36][37]有人认为,在遗传学易感个体中,幽门螺杆菌引发的炎症会导致对自身抗原的耐受性瓦解,如壁细胞上的氢-钾-ATP酶 (H+/K+ ATPase),这或许是因为幽门螺杆菌的脂多糖成分与 H+/K+ ATP 酶都包含 Lewis 表位,引起分子拟态从而产生相关抗体。病理学最初表现为慢性炎症性表现,主要包括泌酸黏膜的淋巴细胞浸润,伴有壁细胞和主细胞的缺失。以后,发生显著的胃腺体萎缩,仅伴散在的淋巴聚集。
胃酸缺乏的其他病因包括治疗消化性溃疡的胃窦切除术与迷走神经切断术以及治疗癌症的大部胃切除术。应当注意的是,由于质子泵抑制剂的血浆半衰期相对较短(1 至 2 小时),它们在体循环中的残留时间有限且每天约 25% 的泵再生,它们在 24 小时后并不完全抑制酸分泌。[38][39][40]
胃萎缩必定与肠上皮化生和高胃泌素血症相关。前者与胃腺癌风险小幅增加(每年 0.1% 至 0.2%)相关,后者与胃类癌肿瘤风险增加相关。[24]在数据监测、流行病学与最终结果医疗保险数据库中一项基于人口的病例对照研究中SEER-Medicare Linked Database发现,恶性贫血的患者患有以下疾病的风险显著增加:非贲门胃腺癌(比值比:2.18)、胃部类癌瘤(比值比:11.43)、扁桃腺癌(比值比:2.00)、下咽部癌(比值比:1.92)、食道鳞癌(比值比:2.12)、小肠癌(比值比:1.63)、肝癌(比值比:1.49)、骨髓瘤(比值比:1.55)急性髓性白血病(比值比:1.68)和骨髓增生异常综合征(比值比:2.87)。[41]高水平的胃泌素通过 CCK-2 受体作用于胃肠嗜铬样 (ECL) 细胞,导致这些细胞增生,并且多年后,部分出现异型增生并转变成类癌,从而导致胃部类癌瘤。[1][42][43][44]萎缩所引起的类癌瘤体积小、多发,且生长缓慢,具有良性表现。[42] [Figure caption and citation for the preceding image starts]: 模型说明胃泌素、组胺、生长抑素 (SST) 和腔内酸对胃酸分泌进行生理调节摘自 Mitchell L. Schubert 教授收集的资料,由 Mary Beatty-Brooks(医学绘图员)确认 [Citation ends].
[Figure caption and citation for the preceding image starts]: 模型说明胃泌素、组胺、生长抑素 (SST) 和腔内酸对胃酸分泌进行生理调节摘自 Mitchell L. Schubert 教授收集的资料,由 Mary Beatty-Brooks(医学绘图员)确认 [Citation ends]. [Figure caption and citation for the preceding image starts]: 图解胃酸缺乏以及胃类癌肿瘤形成的病理生理学的模型摘自 Mitchell L. Schubert 教授收集的资料,由 Mary Beatty-Brooks(医学绘图员)确认 [Citation ends].
[Figure caption and citation for the preceding image starts]: 图解胃酸缺乏以及胃类癌肿瘤形成的病理生理学的模型摘自 Mitchell L. Schubert 教授收集的资料,由 Mary Beatty-Brooks(医学绘图员)确认 [Citation ends].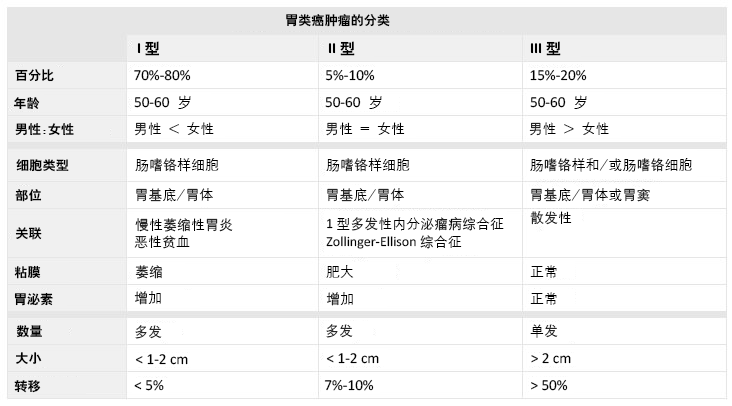 [Figure caption and citation for the preceding image starts]: 胃类癌肿瘤的分类Hou W, Schubert, ML. Treatment of gastric carcinoids.Curr Treat Options Gastroenterol.2007;10:123-133.获 Current Medicine Group LLC 许可使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: 胃类癌肿瘤的分类Hou W, Schubert, ML. Treatment of gastric carcinoids.Curr Treat Options Gastroenterol.2007;10:123-133.获 Current Medicine Group LLC 许可使用 [Citation ends].
虽然通常无症状,但胃类癌在少数情况下可能出现腹痛和出血。
胃酸可能影响某些药物的吸收效率和动力学。胃酸缺乏降低甲状腺素、酮康唑、伊曲康唑、阿扎那韦、头孢泊肟、依诺沙星和双嘧达莫的吸收。[40][45][46]它增加硝苯地平和地高辛的吸收以及阿仑膦酸钠的生物利用度。[46][47][48]
病理生理学
幽门螺杆菌存在于全球半数人群中,大多数慢性感染患者表现为全胃炎且产酸量低于正常值。最初,酸分泌的减少是由于幽门螺杆菌本身以及其在炎症反应过程中的产物对泌酸壁细胞产生的功能性抑制作用。[1][49]例如,幽门螺杆菌抑制人氢-钾-ATP酶 (H+/K+ ATPase) α亚基的表达;[50]其毒素 VacA 阻止含 H+/K+ATP 酶的光面管泡运输到顶端膜;[51]且炎症性浸润释放的细胞因子(如白细胞介素 1β和肿瘤坏死因子-α)会直接抑制壁细胞分泌。[1][52]随着时间的推移,可能出现泌酸腺体萎缩以及壁细胞减少,导致不可逆的胃酸缺乏。越来越多的证据表明,在易感个体中,幽门螺杆菌可能对自身免疫性胃炎的形成发挥重要作用。假设幽门螺旋杆菌感染患者的亚型中出现的抗H+/K+ ATP酶的抗体是微生物的脂多糖成分与质子泵之间的分子拟态(两者均表达 Lewis x 和 y 血型抗原)导致的。这些自身抗体被认为可能对自身免疫性胃炎及其导致的萎缩性胃炎的形成发挥重要作用。[1][36][37]
自身免疫性胃炎也与其他被认为是自身免疫性的疾病相关,如自身免疫性甲状腺疾病(格雷夫斯病 [Graves’ disease]、桥本甲状腺炎 [Hashimoto's thyroiditis] [也被称为自身免疫性甲状腺炎和慢性淋巴细胞性甲状腺炎]、产后甲状腺炎)、1 型糖尿病、特发性肾上腺皮质功能不全、白癜风、甲状旁腺功能减退症和原发性胆汁性肝硬化。[53][54][55][56][57][58]在免疫性甲状腺疾病中,25% 的案例有血清泌酸性萎缩。[59]在原发性胆汁性肝硬化中,抗壁细胞抗体和抗内因子抗体的发生率分别为 32% 和 12%。[53]
手术干预(如胃窦切除术与迷走神经切断术)可能诱发胃酸缺乏。胃酸分泌主要受以下物质调节:肠嗜铬样 (ECL) 细胞释放的组胺,胃窦G 细胞释放的胃泌素以及胃壁中节后神经元释放的乙酰胆碱 (ACh)。[1]胃窦切除术可清除胃泌素,胃泌素是食物摄入期间酸分泌的刺激激素,也是负责泌酸黏膜生长的激素;迷走神经切断术可清除中枢刺激,如对食物的感觉、视觉、嗅觉和味觉。此外,返流到术后残留胃中的胆汁会诱发慢性炎症和萎缩。 [Figure caption and citation for the preceding image starts]: 模型说明胃泌素、组胺、生长抑素 (SST) 和腔内酸对胃酸分泌进行生理调节摘自 Mitchell L. Schubert 教授收集的资料,由 Mary Beatty-Brooks(医学绘图员)确认 [Citation ends].
[Figure caption and citation for the preceding image starts]: 模型说明胃泌素、组胺、生长抑素 (SST) 和腔内酸对胃酸分泌进行生理调节摘自 Mitchell L. Schubert 教授收集的资料,由 Mary Beatty-Brooks(医学绘图员)确认 [Citation ends]. [Figure caption and citation for the preceding image starts]: 图解胃酸缺乏以及胃类癌肿瘤形成的病理生理学的模型摘自 Mitchell L. Schubert 教授收集的资料,由 Mary Beatty-Brooks(医学绘图员)确认 [Citation ends].
[Figure caption and citation for the preceding image starts]: 图解胃酸缺乏以及胃类癌肿瘤形成的病理生理学的模型摘自 Mitchell L. Schubert 教授收集的资料,由 Mary Beatty-Brooks(医学绘图员)确认 [Citation ends].
胃窦 G 细胞释放的胃泌素是食物摄入期间酸分泌的主要刺激激素。胃泌素直接作用于泌酸壁细胞,且更重要的是,它将间接刺激肠嗜铬样 (ECL) 细胞分泌组胺。组胺扩散到邻近的壁细胞中,它与壁细胞上的组胺 H2 受体结合,促进胃酸分泌。在消化间期,胃窦 D 细胞释放生长抑素 (SST)紧张性地抑制G 细胞胃泌素的分泌,从而使酸分泌保持在一定范围内较低的水平。患有胃酸缺乏症的患者,细胞腔内酸对 SST 的刺激性作用丧失了。因此,SST 分泌下降以及其对胃泌素分泌的抑制作用的减弱(去抑制),导致高胃泌素血症。胃泌素不仅是一种促分泌素,而且具有促进消化道黏膜生长的营养作用。如果高胃泌素血症持续数天,ECL 细胞将出现肥大;如果持续数周至数月,ECL 细胞将出现增生肥大、发育异常,并且在某些患者体内形成类癌瘤。
分类
使用此内容应接受我们的免责声明。
