病因学
任何导致低钙血症的疾病均会使甲状旁腺激素 (PTH) 水平升高并引发继发性甲状旁腺功能亢进。有 3 个主要病因会导致该疾病:慢性肾脏病 (CKD)、吸收不良综合征或慢性日晒不足。CKD 患者的肾脏会出现 1-α-羟化酶缺失,从而导致 25-羟基维生素 D 至活性 1,25-二羟基维生素 D 转化率降低。这造成高磷酸血症和低钙血症,从而导致PTH升高。当患有克罗恩病、乳糜泻、慢性胰腺炎或 Whipple 病或胃旁路手术后,往往会存在脂肪吸收不良,而这种脂肪吸收不良会导致维生素 D 和膳食钙吸收下降(如果摄入不足会使病情加重),最终导致低钙血症和 PTH 升高。对大部分人来说,日晒合成了所需维生素 D 的 90%-95%。日晒不足会导致维生素 D 缺乏,这会引起低钙血症,PTH 分泌也随即升高。
胃肠道 (GI) 钙吸收减少:
膳食钙摄入减少
因以下原因导致膳食吸收减少:
乳糖不耐受
胰腺疾病(脂肪吸收不良)
克罗恩病
乳糜泻
胃旁路手术
Whipple 病
维生素 D 缺乏(因维生素 D 摄入和/或吸收减少,或缺乏日晒而影响合成)。
增长的钙损失或增长的代谢要求:
骨骼随着年龄增长而生长
妊娠和哺乳后
双膦酸盐治疗
特发性低钙尿
袢利尿药
横纹肌溶解症
脓毒症
甲状旁腺激素作用降低:
CKD
假性甲状旁腺功能减退症(G-蛋白缺乏)。
病理生理学
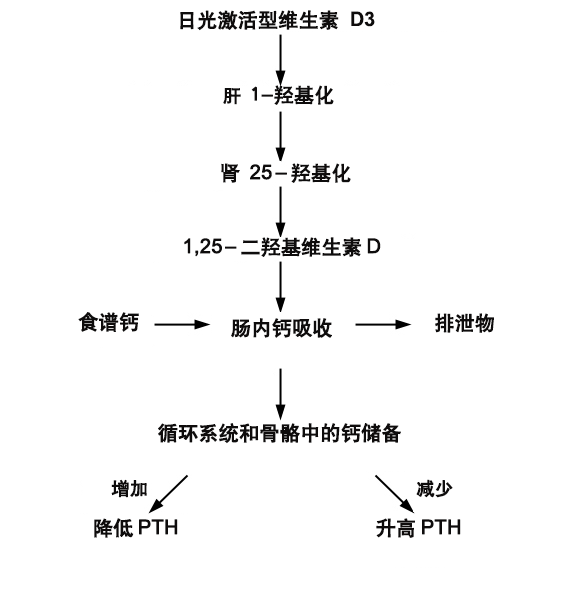
维生素 D 代谢对理解继发性甲状旁腺功能亢进主要原因的病理生理学非常重要。维生素 D 有两种主要形式:胆骨化醇(维生素 D3)和麦角钙化醇(维生素 D2)。
 [Figure caption and citation for the preceding image starts]: 钙生理学激素调节概述由 Brendan C. Stack, Jr. 博士制作;经获准使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: 钙生理学激素调节概述由 Brendan C. Stack, Jr. 博士制作;经获准使用 [Citation ends].
胆骨化醇(维生素 D3)可在日晒后于皮肤中生成,并且少数食物中存在胆骨化醇。日晒合成了大部分人维生素 D 需求的 90%-95%。[3]胆骨化醇天然存在于少数几种食物中:鲑鱼、金枪鱼、马鲛鱼及鱼肝油是最佳来源,牛肝、奶酪及蛋黄中也有少量。麦角钙化醇(维生素 D2)则具有不同于胆骨化醇的侧链。另外经发现一些蘑菇天然存在少量麦角钙化醇。[4]在美国,维生素 D2 和 D3 均被用来强化牛奶、面包和复合维生素。在欧洲,维生素 D3 几乎专门用于复合维生素和食物配方中。
一旦在皮肤中生成或从食物中摄入维生素 D(D2 或 D3),它会经历两次羟基化。第一次是经肝脏羟基化成 25-羟基维生素 D。该化合物随后与维生素 D 结合蛋白 (DBP) 结合进入循环系统并行至肾脏,megalin 受体将肾脏中的 DBP-25-羟基维生素 D 复合物转移至肾小管。此处,经25-羟基维生素 D-1-α-羟化酶 (CYP27B) 导入羟基功能形成 1,25-二羟基维生素 D。[3]
肠道内的 1,25-二羟基维生素 D 诱导表达上皮钙通道、钙-结合蛋白(钙结合素)及其他一些有助于将膳食中的更多钙输送至循环系统的蛋白。[5]1,25-二羟基维生素 D 还与成骨细胞中的维生素 D 核受体相互作用,以刺激化合物受体激动剂(被称为 RANKL)的表达,后者类似于甲状旁腺激素 (PTH)。这样,1,25-二羟基维生素 D 有助于通过增加肠钙吸收的效率和流通骨骼中的钙库来维持钙稳态。
任何一种维生素 D 缺乏均会导致膳食钙(和磷)肠吸收功效降低。这导致离子钙短暂减少,这样会迅速引起 PTH 的产生和分泌升高。PTH 可通过与成熟的成骨细胞上的膜受体相互作用增加离子钙,诱导血浆蛋白受体蛋白 RANKL 的表达。前破骨细胞血浆膜上的 RANK 蛋白识别RANKL 蛋白,通过 RANKL-RANK 之间的相互作用会导致破骨细胞产生和成熟量增加。PTH 还会减少成骨细胞中骨保护素(充当诱饵的 RANKL 样受体)的基因表达,可进一步提高破骨细胞生成。破骨细胞释放盐酸和胶原酶以破坏骨头,从而导致钙库流通到骨骼外。这种由维生素 D 缺乏诱发的继发性甲状旁腺功能亢进导致骨骼损耗,这样会促成并加剧骨质疏松症。[3]
维生素 D 缺乏和继发性甲状旁腺功能亢进的另一个影响是尿液中磷流失和血清磷水平下降。[6]磷酸钙物的不足会导致成骨细胞沉积的骨基质矿化异常。在儿童,身体的重量会导致异常矿化的骨骼发展成弓形腿或膝内翻等典型佝偻病畸形。然而,成人一般具有充分的骨骼矿化,可预防骨骼畸形,但在维生素 D 缺乏的情况下,新沉积的类骨质无法适当矿化,从而导致骨软化症。这与经常被误诊为纤维肌痛、肌炎或慢性疲劳综合征的悸动性骨痛相关。针对这些患者的骨痛,有一种可能的解释,即为较差的矿化类骨质饱含水分,无法充分支持骨膜中的感觉纤维。因此,用手指按压胸骨、胫前,或桡骨或尺骨中轴会引起疼痛。
慢性肾脏病相关的矿物质骨病 (CKD-MBD) 的病理生理学主要与整体肾磷酸盐排泄逐渐下降引起的高磷酸血症相关,但是自相矛盾的是,每个个体肾单位排泄大幅上涨。PTH 和纤维母细胞生长因子-23 (FGF-23) 水平也会升高,两种高磷酸盐尿激素似乎加快血管疾病的发展,特别是在 患CKD 的情况下。[7]该疾病的证据来自弗拉明汉后代研究(该研究证实高磷酸血症甚至与无 CKD 的受试者的心血管疾病事件风险增加相关)[8]和第三次国家健康与营养调查研究 (NHANES)。[9]虽然 CKD-MBD 的病理生理学涉及了 FGF-23,但作为疾病进展的生物标记,其在临床实践中的使用尚待前瞻性试验。还有一些尚未解决的问题需要测定,如何持续大幅降低血清 FGF-23 浓度仍不得而知。
一系列组织形态学异常可见于 CKD 患者中,[10]迄今,由于临床数据不足和疾病异构性质,难以只根据血清生化异常来创建一个可靠准确的分类系统,以协助诊断和治疗。事实上,功能障碍性骨矿物质平衡和软组织钙化并非 CKD 专有的,它是多因子过程,可能不止一个潜在病因。例如,骨脆性、骨折风险增加及伴有动脉粥样硬化病的血管钙化均与正常老化过程相关,可发生于肾功能正常或仅轻度减退的患者中,这些症状在肾功能恶化时仅与 CKD 相关 MBD 同时出现。传统上来说,如果出现生化反应不一致、不明原因的骨痛,或不能诊断为 CKD-MBD 的骨折时可进行骨活检。[1]但是,由于该检查具有侵入性,目前的医疗实践中很少进行。不过框架(虽然仍待审查)已被提出,可根据是否有生化异常、骨病及骨骼外组织钙化对 CKD-MBD 进行分类。[1]
使用此内容应接受我们的免责声明。
