病因学
原发性系统性血管炎是一组病因未明的自身免疫性疾病。 一种病因解释是,暴露于某种不明的抗原,如病毒、毒物或隐藏的抗原表位,可引发免疫反应的激活。[7] 对于某些患者,这种免疫应答没有被下调,从而导致免疫复合物形成并沉积于血管壁,导致血管炎的发生。这一模型遗留有很多未解决的问题。例如,所谓的寡免疫性血管炎并非由免疫复合物介导,不能与这一模型契合。这些类型的血管炎(例如肉芽肿性多血管炎 [韦格纳肉芽肿]、显微镜下多血管炎和嗜酸性肉芽肿性多血管炎 [Churg-Strauss 综合征])通常与抗中性粒细胞胞质抗体 (ANCA) 相关,ANCA 被认为可刺激中性粒细胞脱颗粒,并产生氧自由基,从而间接导致血管损伤。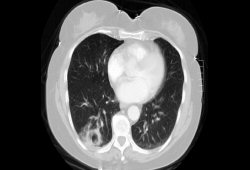 [Figure caption and citation for the preceding image starts]: 胸部CT显示ANCA相关血管炎的一种常见类型——Wegener肉芽肿所导致的肺部空洞性病变。由Dr Philip Seo提供 [Citation ends].
[Figure caption and citation for the preceding image starts]: 胸部CT显示ANCA相关血管炎的一种常见类型——Wegener肉芽肿所导致的肺部空洞性病变。由Dr Philip Seo提供 [Citation ends].
病理生理学
大部分血管炎的诱发因素并不明确。为何累及特定的靶器官是一个十分重要但尚未解决的问题。不过,系统性血管炎的一个共同特征为出现免疫介导的血管壁损伤。血管壁纤维素样坏死伴有核破裂(细胞核破碎和染色质裂解为无结构的颗粒)及红细胞外溢是这种病变的特征性表现。[8] 值得注意的是,血管周围炎症细胞浸润对血管炎不具有诊断意义,此情况也可见于患有其他炎性疾病时。直接免疫荧光可能揭示血管炎可能的病因。IgM 和 C3 沉积与特发性混合型冷球蛋白血症相符。IgA 沉积见于过敏性紫癜患者。免疫荧光下有极微量免疫反应物的寡免疫性血管炎符合抗中性粒细胞胞质抗体相关性血管炎,例如肉芽肿性多血管炎(韦格纳肉芽肿)。 [Figure caption and citation for the preceding image starts]: 显示小动脉典型透壁性炎症的病理样本由法国巴黎Hopital Cochin的MD Loic Guillevin提供 [Citation ends].
[Figure caption and citation for the preceding image starts]: 显示小动脉典型透壁性炎症的病理样本由法国巴黎Hopital Cochin的MD Loic Guillevin提供 [Citation ends]. [Figure caption and citation for the preceding image starts]: 一位Takayasu动脉炎患者的主动脉显微照片显示内膜明显增厚、中膜炎症性浸润以及层状坏死。由Mayo Clinic的MD Dylan Miller提供 [Citation ends].
[Figure caption and citation for the preceding image starts]: 一位Takayasu动脉炎患者的主动脉显微照片显示内膜明显增厚、中膜炎症性浸润以及层状坏死。由Mayo Clinic的MD Dylan Miller提供 [Citation ends].
分类
系统性血管炎的命名[1]
系统性血管炎的亚组可分为大血管炎、中等血管炎和小血管炎。
大血管血管炎
Takayasu 动脉炎
巨细胞动脉炎
中血管血管炎
结节性多动脉炎
川崎病
小血管炎
抗中性粒细胞胞质自身抗体相关血管炎(肉芽肿性多血管炎 [韦格纳肉芽肿]、显微镜下多血管炎、嗜酸性肉芽肿性多血管炎 [Churg-Strauss 综合征])
冷球蛋白血症性血管炎
过敏性紫癜
白细胞破碎性血管炎。
Chapel Hill Consensus Conference目前认可了2个新的血管炎分类。[2]
多血管血管炎
Cogan 综合征
Behcet病。
单器官血管炎
皮肤白细胞破碎性血管炎
皮肤动脉炎
原发性中枢神经系统血管炎
孤立性主动脉炎。
使用此内容应接受我们的免责声明。
