出现动脉瘤破裂的患者需要进行紧急修复术。
对于有症状的主动脉瘤患者,无论直径大小如何,都需要行修复术。[76]Anderson JL, Halperin JL, Albert NM, et al. Management of patients with peripheral artery disease (compilation of 2005 and 2011 ACCF/AHA guideline recommendations): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013 Apr 2;127(13):1425-43.http://circ.ahajournals.org/content/127/13/1425.long
对于偶然发现的无症状 AAA,应优先选择对患者进行监测(相对于修复术),除非理论上的破裂风险超过估计的手术死亡风险。一般而言,修复术适用于无症状的大型 AAA 患者(例如:直径超过 5.5 cm 的美国男性;直径超过 5.0 cm 的美国女性,但如英国的其他国家对较大 AAA 的治疗决策可能不同)。[1]Dehlin JM, Upchurch GR. Management of abdominal aortic aneurysms. Curr Treat Options Cardiovasc Med. 2005 Jun;7(2):119-30.[77]Lederle FA, Wilson SE, Johnson GR, et al; Aneurysm Detection and Management Veterans Affairs Cooperative Study Group. Immediate repair compared with surveillance of small abdominal aortic aneurysms. N Engl J Med. 2002 May 9;346(19):1437-44.[78]UK Small Aneurysm Trial Participants. Mortality results for randomized controlled trial of early elective surgery or ultrasonographic surveillance for small abdominal aortic aneurysms. Lancet. 1998 Nov 21;352(9141):1649-55.[79]Powell JT, Brady AR, Brown LC, et al; United Kingdom Small Aneurysm Trial Participants. Long-term outcomes of immediate repair compared with surveillance of small abdominal aortic aneurysms. N Engl J Med. 2002 May 9;346(19):1445-52.http://www.nejm.org/doi/full/10.1056/NEJMoa013527#t=article[80]Powell JT, Brown LC, Forbes JF, et al. Final 12-year follow-up of surgery versus surveillance in the UK Small Aneurysm Trial. Br J Surg. 2007 Jun;94(6):702-8.[81]Brewster DC, Cronenwett JL, Hallett JW Jr, et al. Guidelines for the treatment of abdominal aortic aneurysms: report of a subcommittee of the Joint Council of the American Association for Vascular Surgery and Society for Vascular Surgery. J Vasc Surg. 2003 May;37(5):1106-17.http://www.jvascsurg.org/article/S0741-5214(03)00421-X/fulltext [  ]How does immediate surgery compare with surveillance in people with asymptomatic abdominal aortic aneurysms?显示答案
]How does immediate surgery compare with surveillance in people with asymptomatic abdominal aortic aneurysms?显示答案
通过进行腔内修复术或开放式手术技术,都可完成对无症状、有症状和破裂动脉瘤的修复;选择手术技术应考虑患者偏好、患者年龄、性别、围手术期危险因素以及解剖因素。
AAA 破裂
患者表现为腹痛和/或背痛、腹部搏动性包块、低血压三联征,由于修复术只是有治愈的可能性,因此需要对患者立即进行复苏和手术评估。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext[82]Harkin DW, Dillon M, Blair PH, et al. Endovascular ruptured abdominal aortic aneurysm repair (EVRAR): a systematic review. Eur J Vasc Endovasc Surg. 2007 Dec;34(6):673-81. 然而,大多数破裂患者在到达手术室前死亡。 [Figure caption and citation for the preceding image starts]: AAA 破裂的 CT 扫描密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
[Figure caption and citation for the preceding image starts]: AAA 破裂的 CT 扫描密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
确诊为 AAA 破裂的患者中,随机接受腔内动脉瘤修复术 (EVAR) 患者的 3 年死亡率低于采用开放修复术方案的患者(48% vs. 56%;风险比 [HR] 为 0.57,95%CI 0.36-0.90)。[83]IMPROVE Trial Investigators. Comparative clinical effectiveness and cost effectiveness of endovascular strategy v open repair for ruptured abdominal aortic aneurysm: three year results of the IMPROVE randomised trial. BMJ. 2017 Nov 14;359:j4859.http://www.bmj.com/content/359/bmj.j4859.long 7 年随访后,治疗组之间的差异不再明显(HR 为 0.92,95%CI 0.75-1.13)。3 年时,随机组之间的再手术率没有显著差异(HR 为 1.02,95%CI 0.79-1.32)。[83]IMPROVE Trial Investigators. Comparative clinical effectiveness and cost effectiveness of endovascular strategy v open repair for ruptured abdominal aortic aneurysm: three year results of the IMPROVE randomised trial. BMJ. 2017 Nov 14;359:j4859.http://www.bmj.com/content/359/bmj.j4859.long一些证据表明,修复 AAA 破裂的腔内方案可能在女性中比在男性中能更有效地降低死亡率。[83]IMPROVE Trial Investigators. Comparative clinical effectiveness and cost effectiveness of endovascular strategy v open repair for ruptured abdominal aortic aneurysm: three year results of the IMPROVE randomised trial. BMJ. 2017 Nov 14;359:j4859.http://www.bmj.com/content/359/bmj.j4859.long[84]Sweeting MJ, Balm R, Desgranges P, et al; Ruptured Aneurysm Trialists. Individual-patient meta-analysis of three randomized trials comparing endovascular versus open repair for ruptured abdominal aortic aneurysm. Br J Surg. 2015 Sep;102(10):1229-39.http://onlinelibrary.wiley.com/doi/10.1002/bjs.9852/full[85]Sweeting MJ, Ulug P, Powell JT, et al; Ruptured Aneurysm Trialists. Ruptured aneurysm trials: the importance of longer-term outcomes and meta-analysis for 1-year mortality. Eur J Vasc Endovasc Surg. 2015 Sep;50(3):297-302.http://www.ejves.com/article/S1078-5884(15)00257-9/fulltext
AAA 破裂的支持治疗
立即采取标准的复苏措施。其中包括:
气道管理(辅助供氧或气管插管并在患者无意识时进行辅助通气)。
 气管插管的动画演示
气管插管的动画演示
 球囊面罩通气的动画演示
球囊面罩通气的动画演示
静脉通路(中心静脉导管)。
动脉导管;导尿管。
低血压复苏:大量补液可能导致稀释性低温凝血功能障碍和血流增加引起的血块破碎、灌注压升高、血液黏稠度降低,从而引起的出血加剧。[89]Crawford ES. Ruptured aortic aneurysm. J Vasc Surg. 1991 Feb;13(2):348-50.[90]Roberts K, Revell M, Youssef H, et al. Hypotensive resuscitation in patients with ruptured abdominal aortic aneurysm. Eur J Vasc Endovasc Surg. 2006 Apr;31(4):339-44.[91]Hardman DT, Fisher CM, Patel MI, et al. Ruptured abdominal aortic aneurysms: who should be offered surgery. J Vasc Surg. 1996 Jan;23(1):123-9.[92]Ohki T, Veith FJ. Endovascular grafts and other image-guided catheter-based adjuncts to improve the treatment of ruptured aortoiliac aneurysms. Ann Surg. 2000 Oct;232(4):466-79. 术前输液量超过 3.5 L 可能增加死亡的相对风险。[89]Crawford ES. Ruptured aortic aneurysm. J Vasc Surg. 1991 Feb;13(2):348-50. 建议术前目标收缩压达到 50 至 70 mmHg 时暂停输液。[90]Roberts K, Revell M, Youssef H, et al. Hypotensive resuscitation in patients with ruptured abdominal aortic aneurysm. Eur J Vasc Endovasc Surg. 2006 Apr;31(4):339-44.[91]Hardman DT, Fisher CM, Patel MI, et al. Ruptured abdominal aortic aneurysms: who should be offered surgery. J Vasc Surg. 1996 Jan;23(1):123-9.[92]Ohki T, Veith FJ. Endovascular grafts and other image-guided catheter-based adjuncts to improve the treatment of ruptured aortoiliac aneurysms. Ann Surg. 2000 Oct;232(4):466-79.
可提供血液制品(压缩红细胞、血小板、新鲜冰冻血浆),复苏、重度贫血及凝血功能障碍时进行输注。
通知麻醉科、ICU 和手术团队。
来自一项多中心随机临床试验的数据支持在 AAA 破裂病例中使用 CT 扫描。[93]Powell JT, Hinchcliffe RJ, Thompson MM, et al; IMPROVE Trial Investigators. Observations from the IMPROVE trial concerning the clinical care of patients with ruptured abdominal aortic aneurysm. Br J Surg. 2014 Feb;101(3):216-24.http://onlinelibrary.wiley.com/doi/10.1002/bjs.9410/full它没有导致显著延迟,并允许进行适当的术前计划。
有症状但未破裂的 AAA
有症状的主动脉瘤患者,无论直径大小如何,都需要行修复术。[76]Anderson JL, Halperin JL, Albert NM, et al. Management of patients with peripheral artery disease (compilation of 2005 and 2011 ACCF/AHA guideline recommendations): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013 Apr 2;127(13):1425-43.http://circ.ahajournals.org/content/127/13/1425.long[94]Erbel R, Aboyans V, Boileau C, et al; ESC Committee for Practice Guidelines. 2014 ESC guidelines on the diagnosis and treatment of aortic diseases: document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. Eur Heart J. 2014 Nov 1;35(41):2873-926.https://academic.oup.com/eurheartj/article/35/41/2873/407693 出现新发疼痛或疼痛加剧,可能预示动脉瘤扩张,即将破裂。因此,最好对有症状但未破裂的动脉瘤进行紧急治疗。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext在某些情况下,干预可能延迟数小时,改善疾病情形以确保成功修复;应在 ICU 中密切监视这些患者。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
EVAR 越来越多地用于治疗有症状的 AAA 患者。[95]De Martino RR, Nolan BW, Goodney PP, Chang CK, et al; Vascular Study Group of Northern New England. Outcomes of symptomatic abdominal aortic aneurysm repair. J Vasc Surg. 2010 Jul;52(1):5-12.e1.http://www.jvascsurg.org/article/S0741-5214(10)00259-4/fulltext[96]Chandra V, Trang K, Virgin-Downey W, et al. Management and outcomes of symptomatic abdominal aortic aneurysms during the past 20 years. J Vasc Surg. 2017 Dec;66(6):1679-85.在观察性研究中,有症状的 AAA 的腔内修复术和开放修复术之间,短期全因死亡率无差异。[95]De Martino RR, Nolan BW, Goodney PP, Chang CK, et al; Vascular Study Group of Northern New England. Outcomes of symptomatic abdominal aortic aneurysm repair. J Vasc Surg. 2010 Jul;52(1):5-12.e1.http://www.jvascsurg.org/article/S0741-5214(10)00259-4/fulltext[96]Chandra V, Trang K, Virgin-Downey W, et al. Management and outcomes of symptomatic abdominal aortic aneurysms during the past 20 years. J Vasc Surg. 2017 Dec;66(6):1679-85.[97]Ten Bosch JA, Willigendael EM, Kruidenier LM, et al. Early and mid-term results of a prospective observational study comparing emergency endovascular aneurysm repair with open surgery in both ruptured and unruptured acute abdominal aortic aneurysms. Vascular. 2012 Apr;20(2):72-80.
来自 2011-2013 年美国外科医师学会全国手术质量改进计划 (American College of Surgeons National Surgical Quality Improvement Program) 的数据表明,进行 EVAR 后,有症状 AAA 患者在 30 天的死亡率大约是无症状 AAA 患者的两倍(有症状的 3.8% vs 无症状的 1.4%,P = 0.001),或者开放修复术后也是如此(有症状的 7.7% vs 无症状的 4.3%,P = 0.08)。[98]Soden PA, Zettervall SL, Ultee KH, et al. Outcomes for symptomatic abdominal aortic aneurysms in the American College of Surgeons National Surgical Quality Improvement Program. J Vasc Surg. 2016 Aug;64(2):297-305.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5065370/更小的患者数可能导致针对开放修复术的报告发现不具有显著统计学意义。
偶然发现小型无症状的 AAA
对于偶然发现的无症状 AAA,应优先选择对患者进行监测(相对于修复术),除非理论上的破裂风险超过估计的手术死亡风险。[3]LeFevre ML; US Preventive Services Task Force. Screening for abdominal aortic aneurysm: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med. 2014 Aug 19;161(4):281-90.http://annals.org/aim/fullarticle/1883339/screening-abdominal-aortic-aneurysm-u-s-preventive-services-task-force[94]Erbel R, Aboyans V, Boileau C, et al; ESC Committee for Practice Guidelines. 2014 ESC guidelines on the diagnosis and treatment of aortic diseases: document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. Eur Heart J. 2014 Nov 1;35(41):2873-926.https://academic.oup.com/eurheartj/article/35/41/2873/407693 较小的 AAA 的早期手术治疗不能降低全因或 AAA 特定死亡率。[3]LeFevre ML; US Preventive Services Task Force. Screening for abdominal aortic aneurysm: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med. 2014 Aug 19;161(4):281-90.http://annals.org/aim/fullarticle/1883339/screening-abdominal-aortic-aneurysm-u-s-preventive-services-task-force[99]Filardo G, Powell JT, Martinez MA, et al. Surgery for small asymptomatic abdominal aortic aneurysms. Cochrane Database Syst Rev. 2015 Feb 8;(2):CD001835.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD001835.pub4/full一项系统评价(包含了 4 项试验,3314 名参与者)发现的高质量证据表明,与监测相比,立即修复小型 AAA(4 到 5.5 cm)不能改善长期生存率(校正 HR 为 0.88,95%CI 0.75-1.02,平均随访 10 年)。[99]Filardo G, Powell JT, Martinez MA, et al. Surgery for small asymptomatic abdominal aortic aneurysms. Cochrane Database Syst Rev. 2015 Feb 8;(2):CD001835.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD001835.pub4/full无论患者年龄、小型动脉瘤的直径以及修复是腔内还是开放性,立即手术均一致地缺乏获益。[99]Filardo G, Powell JT, Martinez MA, et al. Surgery for small asymptomatic abdominal aortic aneurysms. Cochrane Database Syst Rev. 2015 Feb 8;(2):CD001835.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD001835.pub4/full [  ]How does immediate surgery compare with surveillance in people with asymptomatic abdominal aortic aneurysms?显示答案
]How does immediate surgery compare with surveillance in people with asymptomatic abdominal aortic aneurysms?显示答案
较小 AAA 的外科转诊通常适用于增长快速,或者动脉瘤修复术的阈值直径曾达到重复超声检查的患者。[3]LeFevre ML; US Preventive Services Task Force. Screening for abdominal aortic aneurysm: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med. 2014 Aug 19;161(4):281-90.http://annals.org/aim/fullarticle/1883339/screening-abdominal-aortic-aneurysm-u-s-preventive-services-task-force
无症状小动脉瘤的医疗目标包括:
1. 监测:
美国心脏病基金会/美国心脏病协会指南建议,对于经超声/CT 测得直径为 4.0 至 5.4 cm 的肾下/近肾的 AAA,应每 6 至 12 个月接受一次监测。[76]Anderson JL, Halperin JL, Albert NM, et al. Management of patients with peripheral artery disease (compilation of 2005 and 2011 ACCF/AHA guideline recommendations): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013 Apr 2;127(13):1425-43.http://circ.ahajournals.org/content/127/13/1425.longAAA<4.0 cm 需要每 2 至 3 年进行一次超声检查。[76]Anderson JL, Halperin JL, Albert NM, et al. Management of patients with peripheral artery disease (compilation of 2005 and 2011 ACCF/AHA guideline recommendations): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013 Apr 2;127(13):1425-43.http://circ.ahajournals.org/content/127/13/1425.long
英国国家卫生局建议,3.0 至 4.4 cm 的 AAA 应每年进行一次筛查,4.5 至 5.4 cm 的 AAA 应每 3 个月进行一次筛查。[100]NHS England. NHS public health functions agreement 2016-17: service specification No. 23. NHS abdominal aortic aneurysm screening programme. Apr 2016 [internet publication].https://www.england.nhs.uk/commissioning/wp-content/uploads/sites/12/2016/04/serv-spec-23-abdominal-aortic-aneurysm.pdf
一项系统评价和对个体患者数据的 meta 分析得出了结论,3.0 至 4.4 cm AAA 的监测间隔为 2 年,4.5 至 5.4 cm AAA 的监测间隔为 6 个月,这样的监测流程是安全且具有成本效益的。[75]Thompson S, Brown L, Sweeting M, et al; RESCAN Collaborators. Systematic review and meta-analysis of the growth and rupture rates of small abdominal aortic aneurysms: implications for surveillance intervals and their cost-effectiveness. Health Technol Assess. 2013 Sep;17(41):1-118.https://www.journalslibrary.nihr.ac.uk/hta/hta17410/#/abstract
AAA 生长和破裂率的分析表明,为了保持 AAA 破裂风险 <1%,对于基线 AAA 直径为 3.0 cm 的男性,其监测间隔时间应为 8.5 年。[75]Thompson S, Brown L, Sweeting M, et al; RESCAN Collaborators. Systematic review and meta-analysis of the growth and rupture rates of small abdominal aortic aneurysms: implications for surveillance intervals and their cost-effectiveness. Health Technol Assess. 2013 Sep;17(41):1-118.https://www.journalslibrary.nihr.ac.uk/hta/hta17410/#/abstract对于初始动脉瘤直径为 5.0 cm 的男性,其相应的预计监测间隔时间为 17 个月。尽管小型动脉瘤生长率近似,但女性的破裂率比男性高 4 倍。[75]Thompson S, Brown L, Sweeting M, et al; RESCAN Collaborators. Systematic review and meta-analysis of the growth and rupture rates of small abdominal aortic aneurysms: implications for surveillance intervals and their cost-effectiveness. Health Technol Assess. 2013 Sep;17(41):1-118.https://www.journalslibrary.nihr.ac.uk/hta/hta17410/#/abstract监测项目和考虑手术的标准需要针对偶然发现 AAA 的女性专门而定。
2. 扩张和破裂的可纠正危险因素的控制:
戒烟:尼古丁替代疗法、去甲替林、丁胺苯丙酮或咨询。[1]Dehlin JM, Upchurch GR. Management of abdominal aortic aneurysms. Curr Treat Options Cardiovasc Med. 2005 Jun;7(2):119-30.[9]Zankl AR, Schumacher H, Krumsdorf U, et al. Pathology, natural history and treatment of abdominal aortic aneurysms. Clin Res Cardiol. 2007 Mar;96(3):140-51.[11]Singh K, Bønaa H, Jacobsen BK, et al. Prevalence of and risk factors for abdominal aortic aneurysms in a population-based study: The Tromsø Study. Am J Epidemiol. 2001 Aug 1;154(3):236-44.https://academic.oup.com/aje/article/154/3/236/125840[17]Lederle FA, Johnson GR, Wilson SE, et al; Aneurysm Detection and Management (ADAM) Veterans Affairs Cooperative Study Group. Prevalence and associations of abdominal aortic aneurysm detected through screening. Ann Intern Med. 1997 Mar 15;126(6):441-9.[18]Wilmink TB, Quick CR, Day NE. The association between cigarette smoking and abdominal aortic aneurysms. J Vasc Surg. 1999 Dec;30(6):1099-105.[101]Stead LF, Perera R, Bullen C, et al. Nicotine replacement therapy for smoking cessation. Cochrane Database Syst Rev. 2012 Nov 14;(11):CD000146.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD000146.pub4/full[102]Rigotti NA, Clair C, Munafò MR, et al. Interventions for smoking cessation in hospitalised patients. Cochrane Database Syst Rev. 2012 May 16;(5):CD001837.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD001837.pub3/full[103]Hughes JR, Stead LF, Hartmann-Boyce J, et al. Antidepressants for smoking cessation. Cochrane Database Syst Rev. 2014 Jan 8;(1):CD000031.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD000031.pub4/full
使用 β-阻滞剂进行短期治疗不会降低 AAA 扩张速度。[3]LeFevre ML; US Preventive Services Task Force. Screening for abdominal aortic aneurysm: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med. 2014 Aug 19;161(4):281-90.http://annals.org/aim/fullarticle/1883339/screening-abdominal-aortic-aneurysm-u-s-preventive-services-task-force多项临床试验将小型 AAA 患者随机分配接受普萘洛尔治疗以降低动脉瘤扩张速度,研究结果未能证实该药具有明显的防护效果。[104]Rughani G, Robertson L, Clarke M. Medical treatment for small abdominal aortic aneurysms. Cochrane Database Syst Rev. 2012 Sep 12;(9):CD009536.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD009536.pub2/full在这些研究中,普萘洛尔耐受性较差。[104]Rughani G, Robertson L, Clarke M. Medical treatment for small abdominal aortic aneurysms. Cochrane Database Syst Rev. 2012 Sep 12;(9):CD009536.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD009536.pub2/full
3. 积极管理其他心血管疾病:
应治疗可纠正的心血管危险因素,例如高血压和高脂血症。应在手术前至少 1 个月开始使用他汀类药物并无限期持续使用,用以降低心血管死亡率。[74]Moll FL, Powell JT, Fraedrich G, et al; European Society for Vascular Surgery. Management of abdominal aortic aneurysms: clinical practice guidelines of the European Society for Vascular Surgery. Eur J Vasc Endovasc Surg. 2011 Jan;41 Suppl 1:S1-58.http://www.ejves.com/article/S1078-5884(10)00560-5/fulltext
偶然发现无症状的大型 AAA
一般而言,修复术适用于无症状的大型 AAA 患者(例如:直径超过 5.5 cm 的美国男性;直径超过 5.0 cm 的美国女性,但如英国等其他国家对较大 AAA 的治疗可能不同)。修复≥5.5 cm 的动脉瘤可带来生存获益。[1]Dehlin JM, Upchurch GR. Management of abdominal aortic aneurysms. Curr Treat Options Cardiovasc Med. 2005 Jun;7(2):119-30.[78]UK Small Aneurysm Trial Participants. Mortality results for randomized controlled trial of early elective surgery or ultrasonographic surveillance for small abdominal aortic aneurysms. Lancet. 1998 Nov 21;352(9141):1649-55.[79]Powell JT, Brady AR, Brown LC, et al; United Kingdom Small Aneurysm Trial Participants. Long-term outcomes of immediate repair compared with surveillance of small abdominal aortic aneurysms. N Engl J Med. 2002 May 9;346(19):1445-52.http://www.nejm.org/doi/full/10.1056/NEJMoa013527#t=article[80]Powell JT, Brown LC, Forbes JF, et al. Final 12-year follow-up of surgery versus surveillance in the UK Small Aneurysm Trial. Br J Surg. 2007 Jun;94(6):702-8.[81]Brewster DC, Cronenwett JL, Hallett JW Jr, et al. Guidelines for the treatment of abdominal aortic aneurysms: report of a subcommittee of the Joint Council of the American Association for Vascular Surgery and Society for Vascular Surgery. J Vasc Surg. 2003 May;37(5):1106-17.http://www.jvascsurg.org/article/S0741-5214(03)00421-X/fulltext
考虑到患者偏好、患者年龄、性别、围手术期危险因素和解剖危险因素,关于修复的决定应遵循个体化原则。应当认真评估患者的生活质量,并详细咨询手术风险(例如告知患者血管质量计划围手术期死亡风险评分)和术后的生活质量。对于不适合进行开放手术的患者,应考虑 EVAR。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext[77]Lederle FA, Wilson SE, Johnson GR, et al; Aneurysm Detection and Management Veterans Affairs Cooperative Study Group. Immediate repair compared with surveillance of small abdominal aortic aneurysms. N Engl J Med. 2002 May 9;346(19):1437-44.[78]UK Small Aneurysm Trial Participants. Mortality results for randomized controlled trial of early elective surgery or ultrasonographic surveillance for small abdominal aortic aneurysms. Lancet. 1998 Nov 21;352(9141):1649-55.[79]Powell JT, Brady AR, Brown LC, et al; United Kingdom Small Aneurysm Trial Participants. Long-term outcomes of immediate repair compared with surveillance of small abdominal aortic aneurysms. N Engl J Med. 2002 May 9;346(19):1445-52.http://www.nejm.org/doi/full/10.1056/NEJMoa013527#t=article[80]Powell JT, Brown LC, Forbes JF, et al. Final 12-year follow-up of surgery versus surveillance in the UK Small Aneurysm Trial. Br J Surg. 2007 Jun;94(6):702-8.[99]Filardo G, Powell JT, Martinez MA, et al. Surgery for small asymptomatic abdominal aortic aneurysms. Cochrane Database Syst Rev. 2015 Feb 8;(2):CD001835.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD001835.pub4/full破裂:有中等质量证据表明,测量直径大于 5.0 至 6.0 cm 的动脉瘤破裂风险是 20%,在过去十年期间,英国和美国退伍军人事务部开展了 2 项前瞻性随机试验,比较了测量直径为 4.0 至 5.4 cm 肾下 AAA 中早期干预与保守观察的效果。[77]Lederle FA, Wilson SE, Johnson GR, et al; Aneurysm Detection and Management Veterans Affairs Cooperative Study Group. Immediate repair compared with surveillance of small abdominal aortic aneurysms. N Engl J Med. 2002 May 9;346(19):1437-44.[78]UK Small Aneurysm Trial Participants. Mortality results for randomized controlled trial of early elective surgery or ultrasonographic surveillance for small abdominal aortic aneurysms. Lancet. 1998 Nov 21;352(9141):1649-55.[79]Powell JT, Brady AR, Brown LC, et al; United Kingdom Small Aneurysm Trial Participants. Long-term outcomes of immediate repair compared with surveillance of small abdominal aortic aneurysms. N Engl J Med. 2002 May 9;346(19):1445-52.http://www.nejm.org/doi/full/10.1056/NEJMoa013527#t=article受试者<200名的随机对照临床试验(RCT)、受试者>200名且方法学存在缺陷的随机对照临床试验(RCT)、方法学存在缺陷的系统评价或者高质量的观察性(队列)研究。
数据显示,接受择期修复术的较大 AAA (5-5.5 cm) 患者,EVAR 与开放修复术的总生存率相同,但 EVAR 的二次干预比例较高。[105]Greenhalgh RM, Brown LC, Powell JT, et al; United Kingdom EVAR Trial Investigators. Endovascular versus open repair of abdominal aortic aneurysm. N Engl J Med. 2010 May 20;362(20):1863-71. 对于不适合开放修复术的大 AAA(≥5.5 cm)患者,EVAR 可降低 AAA 相关死亡率(但不是长期总生存率)。[106]Greenhalgh RM, Brown LC, Powell JT, et al; United Kingdom EVAR Trial Investigators. Endovascular repair of aortic aneurysm in patients physically ineligible for open repair. N Engl J Med. 2010 May 20;362(20):1872-80.降低不适合开放修复术患者的 AAA 相关死亡率:有来自大型随机对照临床试验的高质量证据表明,与未行修复术的患者相比,腹主动脉瘤直径为 5.5 cm 或以上、但身体状况不适合行开放修复术的患者接受腔内修复术 (EVAR) 治疗可显著降低 AAA 相关的死亡率,但 8 年后的总死亡率没有降低。然而,EVAR 后,与移植相关并发症和二次干预的比例较高。[106]Greenhalgh RM, Brown LC, Powell JT, et al; United Kingdom EVAR Trial Investigators. Endovascular repair of aortic aneurysm in patients physically ineligible for open repair. N Engl J Med. 2010 May 20;362(20):1872-80.系统评价或者受试者>200名的随机对照临床试验(RCT)。在行修复术之后,较大的 AAA 与较小的动脉瘤相比似乎具有较差的晚期存活率(AAA 直径每增加 1 cm,汇总 HR 1.14,95%CI 1.09-1.18;随访 12-91.2 个月)。[107]Khashram M, Hider PN, Williman JA, et al. Does the diameter of abdominal aortic aneurysm influence late survival following abdominal aortic aneurysm repair? A systematic review and meta-analysis. Vascular. 2016 Dec;24(6):658-67.此关联性在 EVAR 中比开放修复术中更明显。
对无症状患者的择期修复术需要术前评估、心脏风险分层以及对其他合并症的医学优化管理。冠状动脉疾病仍是 AAA 修复术后早期和远期死亡的主要原因。
腔内动脉瘤修复术 (EVAR)
EVAR 是将覆膜支架移植物经股动脉血管送进主动脉,使动脉瘤壁不受体循环压力压迫,防止破裂,并使囊萎缩。主动脉瘤内支架可通过低轮廓装置经皮置入,或者手术暴露股动脉后置入。一项 Cochrane 评价发现,短期随访(6 个月)后,除了经皮处理方式可能更快之外,不同手术技术之间无差异。[108]Gimzewska M, Jackson AI, Yeoh SE, et al. Totally percutaneous versus surgical cut-down femoral artery access for elective bifurcated abdominal endovascular aneurysm repair. Cochrane Database Syst Rev. 2017 Feb 21;(2):CD010185.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD010185.pub3/full缺少低轮廓装置稳定性的长期数据。 [Figure caption and citation for the preceding image starts]: 腔内动脉瘤修复术 (EVAR) 所用的各种血管内支架密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
[Figure caption and citation for the preceding image starts]: 腔内动脉瘤修复术 (EVAR) 所用的各种血管内支架密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends]. [Figure caption and citation for the preceding image starts]: 腔内动脉瘤修复术 (EVAR)密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
[Figure caption and citation for the preceding image starts]: 腔内动脉瘤修复术 (EVAR)密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
应使用 0.5 mm 层厚的 CT 血管造影术评估 EVAR 的适用性。操作者必须熟悉要使用的主动脉瘤内支架的明确使用说明。
在施行 AAA 的 EVAR 后,推荐使用超声检查或 CT 进行终生年度监测。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext[74]Moll FL, Powell JT, Fraedrich G, et al; European Society for Vascular Surgery. Management of abdominal aortic aneurysms: clinical practice guidelines of the European Society for Vascular Surgery. Eur J Vasc Endovasc Surg. 2011 Jan;41 Suppl 1:S1-58.http://www.ejves.com/article/S1078-5884(10)00560-5/fulltext
开放修复术
开放修复术可以是经腹膜或腹膜后入路。控制主动脉近端和远端后,打开动脉瘤,结扎回血的分支动脉,在正常的主动脉近端到正常的主动脉远端(或髂段)间缝合人工血管移植物。双侧髂动脉恢复血流后,在移植物上方关闭动脉瘤囊。[109]Eliason JL, Upchurch GR. Endovascular abdominal aortic aneurysms repair. Circulation. 2008 Apr 1;117(13):1738-44.http://circ.ahajournals.org/content/117/13/1738.full如果患者的动脉瘤扩展到近肾和/或内脏主动脉段,或出现炎症性动脉瘤、马蹄肾或腹腔难以进入,应当考虑腹膜后入路。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext[110]Cambria RP, Brewster DC, Abbott WM, et al. Transperitoneal versus retroperitoneal approach for aortic reconstruction: a randomized prospective study. J Vasc Surg. 1990 Feb;11(2):314-24.[111]Sicard GA, Reilly JM, Rubin BG, et al. Transabdominal versus retroperitoneal incision for abdominal aortic surgery: report of a prospective randomized trial. J Vasc Surg. 1995 Feb;21(2):174-81.
如果不存在严重的髂动脉疾病,建议使用直管移植物修复。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext 近端主动脉吻合术应当尽可能靠近肾动脉。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext 建议主动脉移植物的所有部分都不应当直接接触腹膜腔的肠内容物。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext 如果结肠缺血风险增加(即:伴有腹腔或肠系膜上动脉闭塞性疾病、肠系膜动脉弓增宽、既往结肠切除史、不能维持下腹灌注、大量失血或术中低血压、移植血管开放时肠系膜下动脉回血不良、多普勒显示结肠血流不良或结肠缺血),应当考虑开放肠系膜下动脉 (inferior mesenteric artery, IMA) 重新移植。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext[112]Senekowitsch C, Assadian A, Assadian O, et al. Replanting the inferior mesentery artery during infrarenal aortic aneurysm repair: influence on postoperative colon ischemia. J Vasc Surg. 2006 Apr;43(4):689-94.
选择择期修复术
EVAR 在美国所有 AAA 修复术中占 70% 以上。[113]Beck AW, Sedrakyan A, Mao J, et al; International Consortium of Vascular Registries. Variations in abdominal aortic aneurysm care: a report from the International Consortium of Vascular Registries. Circulation. 2016 Dec 13;134(24):1948-58.http://circ.ahajournals.org/content/134/24/1948.long在英国,2014-15 年期间,69% 的择期肾下 AAA 和 89% 的复杂 AAA 通过 EVAR 进行治疗。[114]Royal College of Surgeons and Vascular Society of Great Britain and Ireland. National Vascular Registry: 2016 annual report. Nov 2016 [internet publication].https://www.vsqip.org.uk/content/uploads/2016/12/National-Vascular-Registry-2016-Annual-Report.pdf但是,并非所有患者都适合 EVAR。因此,指南推荐采用个体化方法进行手术选择。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext[74]Moll FL, Powell JT, Fraedrich G, et al; European Society for Vascular Surgery. Management of abdominal aortic aneurysms: clinical practice guidelines of the European Society for Vascular Surgery. Eur J Vasc Endovasc Surg. 2011 Jan;41 Suppl 1:S1-58.http://www.ejves.com/article/S1078-5884(10)00560-5/fulltext[76]Anderson JL, Halperin JL, Albert NM, et al. Management of patients with peripheral artery disease (compilation of 2005 and 2011 ACCF/AHA guideline recommendations): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013 Apr 2;127(13):1425-43.http://circ.ahajournals.org/content/127/13/1425.long[115]Hirsch AT, Haskal ZJ, Hertzer NR, et al. ACC/AHA 2005 practice guidelines for the management of patients with peripheral arterial disease (lower extremity, renal, mesenteric, and abdominal aortic). Circulation. 2006 Mar 21;113(11):e463-654.http://circ.ahajournals.org/content/113/11/e463.long[116]Kristensen SD, Knuuti J, Saraste A, et al; Authors/Task Force Members. 2014 ESC/ESA guidelines on non-cardiac surgery: cardiovascular assessment and management. Eur Heart J. 2014 Sep 14;35(35):2383-431.https://academic.oup.com/eurheartj/article/35/35/2383/425095影响决定的因素包括:解剖决定因素(例如动脉瘤直径、颈长、颈直径);预期寿命、性别、共病;以及围手术期风险。
可首选 EVAR 的患者包括:
有更低的围手术期风险且解剖学情况良好的患者也可进行 EVAR。[117]Siracuse JJ, Gill HL, Graham AR, et al. Comparative safety of endovascular and open surgical repair of abdominal aortic aneurysms in low-risk male patients. J Vasc Surg. 2014 Nov;60(5):1154-8.http://www.jvascsurg.org/article/S0741-5214(14)00999-9/fulltext[118]Kontopodis N, Antoniou SA, Georgakarakos E, et al. Endovascular vs open aneurysm repair in the young: systematic review and meta-analysis. J Endovasc Ther. 2015 Dec;22(6):897-904.应考虑修复术的安全性和耐久性(需要再次手术)。
可首选开放修复术的患者包括:
美国心脏病学会/美国心脏协会临床指南(2005 和 2011 年指南建议汇编)建议,开放动脉瘤修复术治疗适用于不能遵从 EVAR 后需要长期监测的患者。[76]Anderson JL, Halperin JL, Albert NM, et al. Management of patients with peripheral artery disease (compilation of 2005 and 2011 ACCF/AHA guideline recommendations): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013 Apr 2;127(13):1425-43.http://circ.ahajournals.org/content/127/13/1425.long开放修复术还适用于可考虑进行 EVAR 但解剖情况不佳的患者。[119]Joels CS, Langan EM 3rd, Daley CA, et al. Changing indications and outcomes for open abdominal aortic aneurysm repair since the advent of endovascular repair. Am Surg. 2009 Aug;75(8):665-9.
择期修复术的结局
有关 EVAR 和开放修复术的安全性和有效性比较的数据根据关注的结局而有所不同。迄今的证据表明:
腔内修复术的短期术后死亡率(≤30 天)低于开放修复术
无论是开放修复术还是 EVAR,女性手术期间、围手术期和术后死亡率(≤30 天)都高于男性。
EVAR 后的动脉瘤相关死亡率(修复术后≥3 年)高于开放修复术后
EVAR 后的总体再手术率比开放修复术后更高。
接受 EVAR 的 AAA 患者术后六个月的死亡率低于接受开放修复术的患者,但这主要是因为 30 天的手术死亡率较低。[120]Powell JT, Sweeting MJ, Ulug P, et al; EVAR, DREAM, OVER and ACE Trialists. Meta-analysis of individual-patient data from EVAR-1, DREAM, OVER and ACE trials comparing outcomes of endovascular or open repair for abdominal aortic aneurysm over 5 years. Br J Surg. 2017 Feb;104(3):166-78.http://onlinelibrary.wiley.com/doi/10.1002/bjs.10430/full来自 4 项高质量随机临床试验的汇总分析(受试者为直径 >5 cm 的 AAA 患者)发现,随机接受 EVAR 患者的短期死亡率(30 天或住院死亡率)显著低于接受开放修复术的患者(1.4% vs. 4.2%,比值 [OR] 为 0.33,95%CI 0.20-0.55;P<0.0001)。[121]Paravastu SC, Jayarajasingam R, Cottam R, et al. Endovascular repair of abdominal aortic aneurysm. Cochrane Database Syst Rev. 2014 Jan 23;(1):CD004178.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD004178.pub2/full 但是,EVAR 的早期获益随着随访而减少。[120]Powell JT, Sweeting MJ, Ulug P, et al; EVAR, DREAM, OVER and ACE Trialists. Meta-analysis of individual-patient data from EVAR-1, DREAM, OVER and ACE trials comparing outcomes of endovascular or open repair for abdominal aortic aneurysm over 5 years. Br J Surg. 2017 Feb;104(3):166-78.http://onlinelibrary.wiley.com/doi/10.1002/bjs.10430/full[121]Paravastu SC, Jayarajasingam R, Cottam R, et al. Endovascular repair of abdominal aortic aneurysm. Cochrane Database Syst Rev. 2014 Jan 23;(1):CD004178.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD004178.pub2/full随机接受 EVAR 或开放修复术的患者的长期死亡率(>4 年)没有差异(37.3% vs 37.8%,OR 为 0.98,95%CI 0.83~1.15;P = 0.78)。在英国的腔内动脉瘤修复术试验 1 中,随访超过 8 年后,发现开放修复术的全因死亡率显著低于 EVAR(46% vs. 53%,P=0.048)。[122]Patel R, Sweeting MJ, Powell JT, et al; EVAR Trial Investigators. Endovascular versus open repair of abdominal aortic aneurysm in 15-years' follow-up of the UK endovascular aneurysm repair trial 1 (EVAR trial 1): a randomised controlled trial. Lancet. 2016 Nov 12;388(10058):2366-74.http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(16)31135-7/fulltext
女性围手术期和短期死亡率高于男性。在择期 AAA 修复期间,对于开放修复术和腔内修复术,女性的手术死亡率都超过男性,死亡率比分别为 7.0% vs 5.2%、2.1% vs 1.3%。[123]Schermerhorn ML, Bensley RP, Giles KA, et al. Changes in abdominal aortic aneurysm rupture and short-term mortality, 1995-2008: a retrospective observational study. Ann Surg. 2012 Oct;256(4):651-8.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3507435/ 在英国,尽管存在较少的术前心血管危险因素,相较于男性患者,接受择期 AAA 修复术的女性短期死亡率高,具体为开放修复术(30 天的死亡率:OR 为 1.39;95%CI 1.25-1.56)和 EVAR (30 天的死亡率:OR 为 1.57;95%CI 1.23-2.00)。[124]Desai M, Choke E, Sayers RD, et al. Sex-related trends in mortality after elective abdominal aortic aneurysm surgery between 2002 and 2013 at National Health Service hospitals in England: less benefit for women compared with men. Eur Heart J. 2016 Dec 7;37(46):3452-60.https://academic.oup.com/eurheartj/article/37/46/3452/2661739/Sex-related-trends-in-mortality-after-elective女性性别是接受过开放修复术患者的全因死亡率的一个独立危险因素,女性、男性患者开放修复术后 1 年时粗略累积全因死亡率分别为 15.9% vs 12.1%(P <0.001),在 5 年时为 22.2% vs 19.6% (P <0.001)。[124]Desai M, Choke E, Sayers RD, et al. Sex-related trends in mortality after elective abdominal aortic aneurysm surgery between 2002 and 2013 at National Health Service hospitals in England: less benefit for women compared with men. Eur Heart J. 2016 Dec 7;37(46):3452-60.https://academic.oup.com/eurheartj/article/37/46/3452/2661739/Sex-related-trends-in-mortality-after-electiveEVAR 组的女性和男性的长期全因生存率没有显著差异 (P = 0.356)。
来自 4 项临床试验的个体患者数据的 meta 分析发现,3 年后,EVAR 组患者的动脉瘤相关死亡率显著高于进行开放修复术的患者(汇总风险比 [HR] 为 5.16,95%CI 1.49-17.89;P = 0.010)。[120]Powell JT, Sweeting MJ, Ulug P, et al; EVAR, DREAM, OVER and ACE Trialists. Meta-analysis of individual-patient data from EVAR-1, DREAM, OVER and ACE trials comparing outcomes of endovascular or open repair for abdominal aortic aneurysm over 5 years. Br J Surg. 2017 Feb;104(3):166-78.http://onlinelibrary.wiley.com/doi/10.1002/bjs.10430/full来自英国腔内动脉瘤修复术临床试验 1 的数据指出,随访>8 年后,EVAR 患者的动脉瘤相关死亡率高于开放修复术患者 (5% vs 1%,P = 0.0064)。[122]Patel R, Sweeting MJ, Powell JT, et al; EVAR Trial Investigators. Endovascular versus open repair of abdominal aortic aneurysm in 15-years' follow-up of the UK endovascular aneurysm repair trial 1 (EVAR trial 1): a randomised controlled trial. Lancet. 2016 Nov 12;388(10058):2366-74.http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(16)31135-7/fulltext经过 8 年的随访,一项大型队列研究发现,进行 EVAR 后的患者出现动脉瘤破裂情况比进行开放修复术的患者更常见 (5.4% vs 1.4%,P< 0.001)。[125]Schermerhorn ML, Buck DB, O'Malley AJ, et al. Long-term outcomes of abdominal aortic aneurysm in the Medicare population. N Engl J Med. 2015 Jul 23;373(4):328-38.http://www.nejm.org/doi/full/10.1056/NEJMoa1405778#t=articleMeta 分析发现,以下三种情况的发病率在 EVAR 和开放修复术之间无显著差异:心肌死亡(OR 为 1.14,95%CI 0.86-1.52;P=0.36)、致命卒中(OR 为 0.81,95%CI 0.42-1.55;P=0.52)或非致死性卒中(OR 为 0.81,95%CI 0.50-1.31;P=0.39)。[121]Paravastu SC, Jayarajasingam R, Cottam R, et al. Endovascular repair of abdominal aortic aneurysm. Cochrane Database Syst Rev. 2014 Jan 23;(1):CD004178.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD004178.pub2/full中度肾功能不全或心血管疾病患者不能从 EVAR 获得早期生存益处(至 6 个月),但外周动脉病患者可从开放修复术中获益。[120]Powell JT, Sweeting MJ, Ulug P, et al; EVAR, DREAM, OVER and ACE Trialists. Meta-analysis of individual-patient data from EVAR-1, DREAM, OVER and ACE trials comparing outcomes of endovascular or open repair for abdominal aortic aneurysm over 5 years. Br J Surg. 2017 Feb;104(3):166-78.http://onlinelibrary.wiley.com/doi/10.1002/bjs.10430/full在另一项 meta 分析中,择期 AAA 修复术(EVAR 或开放修复术)后,长期生存率最差的患者是终末期肾病患者(HR 为 3.15,95%CI 2.45-4.04)和需要补充氧气的 COPD 患者(HR 为 3.05,95%CI 1.93-4.80)。[126]Khashram M, Williman JA, Hider PN, et al. Systematic review and meta-analysis of factors influencing survival following abdominal aortic aneurysm repair. Eur J Vasc Endovasc Surg. 2016 Feb;51(2):203-15.http://www.ejves.com/article/S1078-5884(15)00682-6/fulltext
EVAR 的总体再手术率高于开放手术;但是,临床试验中报告的比率是异质性的。[120]Powell JT, Sweeting MJ, Ulug P, et al; EVAR, DREAM, OVER and ACE Trialists. Meta-analysis of individual-patient data from EVAR-1, DREAM, OVER and ACE trials comparing outcomes of endovascular or open repair for abdominal aortic aneurysm over 5 years. Br J Surg. 2017 Feb;104(3):166-78.http://onlinelibrary.wiley.com/doi/10.1002/bjs.10430/full[121]Paravastu SC, Jayarajasingam R, Cottam R, et al. Endovascular repair of abdominal aortic aneurysm. Cochrane Database Syst Rev. 2014 Jan 23;(1):CD004178.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD004178.pub2/full在个体患者数据的汇总分析中,随访的 5 年里,患 I 型内漏的 EVAR 患者中,再手术率为 65.8%(120 人中有 79 人再手术),患 II 型内漏的 EVAR 患者中,再手术率为 22.8%(435 人中有 99 人再手术)。[120]Powell JT, Sweeting MJ, Ulug P, et al; EVAR, DREAM, OVER and ACE Trialists. Meta-analysis of individual-patient data from EVAR-1, DREAM, OVER and ACE trials comparing outcomes of endovascular or open repair for abdominal aortic aneurysm over 5 years. Br J Surg. 2017 Feb;104(3):166-78.http://onlinelibrary.wiley.com/doi/10.1002/bjs.10430/full观察性数据表明,在随访的 8 年中,EVAR 后需要与动脉瘤或其并发症管理的相关干预比开放手术更为常见 (18.8% vs. 3.7%, P<0.001)。[125]Schermerhorn ML, Buck DB, O'Malley AJ, et al. Long-term outcomes of abdominal aortic aneurysm in the Medicare population. N Engl J Med. 2015 Jul 23;373(4):328-38.http://www.nejm.org/doi/full/10.1056/NEJMoa1405778#t=article
来自 4 项小规模随机对照临床试验 (RCT) 的低质量证据表明,与经腹膜入路相比,经腹膜后入路的择期开放修复术可减少失血和住院时间。[127]Ma B, Wang YN, Chen KY, et al. Transperitoneal versus retroperitoneal approach for elective open abdominal aortic aneurysm repair. Cochrane Database Syst Rev. 2016 Feb 5;(2):CD010373.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD010373.pub2/full然而,腹膜后和经腹膜择期开放 AAA 修复术之间的死亡率没有差异(来自极低质量的证据)。此外,与经腹膜入路相比,腹膜后干预可能增加血肿、慢性创伤疼痛和腹壁疝的风险。[127]Ma B, Wang YN, Chen KY, et al. Transperitoneal versus retroperitoneal approach for elective open abdominal aortic aneurysm repair. Cochrane Database Syst Rev. 2016 Feb 5;(2):CD010373.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD010373.pub2/full
不良反应
EVAR 并发症可能包括内漏、移植物闭塞、移植物移位伴主动脉颈扩张。[115]Hirsch AT, Haskal ZJ, Hertzer NR, et al. ACC/AHA 2005 practice guidelines for the management of patients with peripheral arterial disease (lower extremity, renal, mesenteric, and abdominal aortic). Circulation. 2006 Mar 21;113(11):e463-654.http://circ.ahajournals.org/content/113/11/e463.long一项系统评价报道指出 24.6% 接受 EVAR 的患者(纳入 9439 名男性患者)会发生主动脉颈部扩张,这会导致 I 型内漏、移植物移位和再手术率升高。[128]Kouvelos GN, Oikonomou K, Antoniou GA, et al. A systematic review of proximal neck dilatation after endovascular repair for abdominal aortic aneurysm. J Endovasc Ther. 2017 Feb;24(1):59-67.
接受开放修复术有高风险的患者,在某些解剖情况下,可进行双侧腹下动脉闭塞术,这是 EVAR 的辅助手段。单侧栓塞后,臀跛行和勃起功能障碍可见于多达 40% 的患者;双侧闭塞后,11% 至 13% 的患者可能持续出现这些症状。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext[129]Farahmand P, Becquemin JP, Desgranges P, et al. Is hypogastric artery embolization during endovascular aortoiliac aneurysm repair (EVAR) innocuous and useful? Eur J Vasc Endovasc Surg. 2008 Apr;35(4):429-35.[130]Mehta M, Veith FJ, Ohki T, et al. Unilateral and bilateral hypogastric artery interruption during aortoiliac aneurysm repair in 154 patients: a relatively innocuous procedure. J Vasc Surg. 2001 Feb;33(2 Suppl):S27-32.髂内动脉血管重建技术(涉及专科用髂动脉分支型支架 [iliac branch device])具有高技术成功率,且并发症发生率较低(例如臀跛行率为 4.1%)。[131]Kouvelos GN, Katsargyris A, Antoniou GA, et al. Outcome after interruption or preservation of internal iliac artery flow during endovascular repair of abdominal aorto-iliac aneurysms. Eur J Vasc Endovasc Surg. 2016 Nov;52(5):621-34.
对于同时有腹腔内恶性肿瘤的患者,尽管存在血栓形成事件的显著风险,EVAR 可降低患者死亡率并延迟 2 种病理学治疗的时间。[132]Kumar R, Dattani N, Asaad O, et al. Meta-analysis of outcomes following aneurysm repair in patients with synchronous intra-abdominal malignancy. Eur J Vasc Endovasc Surg. 2016 Dec;52(6):747-56.[133]Kouvelos GN, Patelis N, Antoniou GA, et al. Management of concomitant abdominal aortic aneurysm and colorectal cancer. J Vasc Surg. 2016 May;63(5):1384-93.
开放修复术的并发症包括心肺事件、肠系膜缺血、肾功能衰竭、出血、创伤和移植物感染、脊髓缺血/截瘫、栓塞/肢体缺血、迟发性移植并发症(即主动脉肠瘘和主动脉假性动脉瘤)。[1]Dehlin JM, Upchurch GR. Management of abdominal aortic aneurysms. Curr Treat Options Cardiovasc Med. 2005 Jun;7(2):119-30.[134]Johnston KW. Multicenter prospective study of nonruptured abdominal aortic aneurysm. Part II. Variables predicting morbidity and mortality. J Vasc Surg. 1989 Mar;9(3):437-47.
围手术期管理
合并心脏病的治疗:
在 AAA 筛查项目的患者中,应优先考虑心血管风险的预防。[135]Saratzis A, Sidloff D, Bown MJ. Cardiovascular risk in patients with small abdominal aortic aneurysms. Spring meeting for clinician scientists in training 2017: poster abstract. Lancet. 2017 Feb 23;389(S89).http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)30485-3/fulltext
针对有 ≥3 个临床危险因素史(即:冠状动脉疾病、充血性心力衰竭、卒中、糖尿病、慢性肾功能不全),且功能能力未知或较差 (MET <4) 的患者,如果要改变管理方式,应当考虑进行非侵入性压力测试。
冠状动脉重建适用于急性 ST 段抬高型心肌梗死、不稳定型心绞痛或者伴有冠状动脉左主干或 3 支病变的稳定型心绞痛患者,以及患有包含冠状动脉左前降支近端在内的 2 支血管病变且无创性检查显示缺血或射血分数 <0.5 的患者。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
关于输血:[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
术前储存式自体输血可能对接受动脉瘤开放修复术的患者有益。
如果预计大量失血或库存血有传播疾病的风险高,建议血液回收或使用超滤设备。
如果持续失血且术中血红蛋白水平 <10 g/dL,建议输血。考虑使用新鲜冰冻血浆和血小板以及压缩血细胞,比例为 1:1:1。
主动脉手术中,不应当常规使用肺动脉导管,除非存在严重血液动力学紊乱的高风险。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext 建议所有接受动脉瘤开放修复术的患者建立中心静脉通路。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext 建议对所有接受开放修复术或 EVAR 的患者进行深静脉血栓预防措施,包括间歇气压疗法和早期离床活动。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext[136]Bani-Hani MG, AL Khaffaf H, Titi MA, et al. Interventions for preventing venous thromboembolism following abdominal aortic surgery. Cochrane Database Syst Rev. 2008 Jan 23;(1):CD005509.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD005509.pub2/full
在进行开放修复术和 EVAR 期间避免体温降低可减少住院时长、ITU 停留时长以及器官功能障碍率。[137]Samoila G, Ford RT, Glasbey JC, et al. The significance of hypothermia in abdominal aortic aneurysm repair. Ann Vasc Surg. 2017 Jan;38:323-31.
降低术前心血管风险:
术前解决可纠正的心血管危险因素能够改善 AAA 修复术后的长期生存率。[138]Khashram M, Williman JA, Hider PN, et al. Management of modifiable vascular risk factors improves late survival following abdominal aortic aneurysm repair: a systematic review and meta-analysis. Ann Vasc Surg. 2017 Feb;39:301-11.
一项针对接受开放或腔内 AAA 修复术患者的小型随机对照试验证实,术前运动锻炼可减少术后心脏并发症。[139]Barakat HM, Shahin Y, Khan JA, et al. Preoperative supervised exercise improves outcomes after elective abdominal aortic aneurysm repair: a randomized controlled trial. Ann Surg. 2016 Jul;264(1):47-53.
围手术期使用他汀类药物可减少非心脏手术中的心血管事件。[140]Fleisher LA, Fleischmann KE, Auerbach AD, et al. 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014 Dec 9;130(24):e278-333.http://circ.ahajournals.org/content/130/24/e278.long 应在手术前至少 1 个月开始使用他汀类药物并持续无限期使用,用以降低心血管死亡率。[74]Moll FL, Powell JT, Fraedrich G, et al; European Society for Vascular Surgery. Management of abdominal aortic aneurysms: clinical practice guidelines of the European Society for Vascular Surgery. Eur J Vasc Endovasc Surg. 2011 Jan;41 Suppl 1:S1-58.http://www.ejves.com/article/S1078-5884(10)00560-5/fulltext
在无禁忌症时,患者应接受小剂量阿司匹林治疗,并且应在围手术期间持续使用。[74]Moll FL, Powell JT, Fraedrich G, et al; European Society for Vascular Surgery. Management of abdominal aortic aneurysms: clinical practice guidelines of the European Society for Vascular Surgery. Eur J Vasc Endovasc Surg. 2011 Jan;41 Suppl 1:S1-58.http://www.ejves.com/article/S1078-5884(10)00560-5/fulltext
应控制高血压,以降低心血管并发症发病率。[74]Moll FL, Powell JT, Fraedrich G, et al; European Society for Vascular Surgery. Management of abdominal aortic aneurysms: clinical practice guidelines of the European Society for Vascular Surgery. Eur J Vasc Endovasc Surg. 2011 Jan;41 Suppl 1:S1-58.http://www.ejves.com/article/S1078-5884(10)00560-5/fulltext
如果可以在手术前 1 个多月开始治疗,那么对于心肌缺血(缺血性心脏病或负荷试验中出现心肌缺血)高危患者,在围手术期使用 β 受体阻断剂可能是合理的。[74]Moll FL, Powell JT, Fraedrich G, et al; European Society for Vascular Surgery. Management of abdominal aortic aneurysms: clinical practice guidelines of the European Society for Vascular Surgery. Eur J Vasc Endovasc Surg. 2011 Jan;41 Suppl 1:S1-58.http://www.ejves.com/article/S1078-5884(10)00560-5/fulltext[141]Chen RJ, Chu H, Tsai LW. Impact of beta-blocker initiation timing on mortality risk in patients with diabetes mellitus undergoing noncardiac surgery: a nationwide population-based cohort study. J Am Heart Assoc. 2017 Jan 10;6(1):e004392.http://jaha.ahajournals.org/content/6/1/e004392.long手术前数天开始使用 β 受体阻断剂的大型临床试验已表明,在手术期使用 β 受体阻断剂没有益处,甚至还会有害。[142]Brady AR, Gibbs JS, Greenhalgh RM, et al; POBBLE Trial Investigators. Perioperative beta-blockade (POBBLE) for patients undergoing infrarenal vascular surgery: results of a randomized double-blind controlled trial. J Vasc Surg. 2005 Apr;41(4):602-9.http://www.jvascsurg.org/article/S0741-5214(05)00189-8/fulltext[143]Devereaux PJ, Yang H, Yusuf S, et al; POISE Study Group. Effects of extended-release metoprolol succinate in patients undergoing non-cardiac surgery (POISE trial): a randomised controlled trial. Lancet. 2008 May 31;371(9627):1839-47.http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(08)60601-7/fulltext[144]Yang H, Raymer K, Butler R, et al. The effects of perioperative beta-blockade: results of the Metoprolol after Vascular Surgery (MaVS) study, a randomized controlled trial. Am Heart J. 2006 Nov;152(5):983-90.
一项针对非心脏手术患者的大型、多中心研究发现,可乐定不能降低死亡率或非致命性心肌梗死发生率。[145]Devereaux PJ, Mrkobrada M, Sessler DI, et al. Aspirin in patients undergoing noncardiac surgery. N Engl J Med. 2014 Apr 17;370(16):1494-503.http://www.nejm.org/doi/full/10.1056/NEJMoa1401105#t=article 因此不推荐将 α-2 受体激动剂用于非心脏手术患者。[140]Fleisher LA, Fleischmann KE, Auerbach AD, et al. 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014 Dec 9;130(24):e278-333.http://circ.ahajournals.org/content/130/24/e278.long
抗生素覆盖:
腔内动脉瘤修复术 (EVAR) 渗漏
内漏是移植物外动脉瘤囊内的持续血流。[146]Schurink GW, Aarts NJ, vanBockel JH. Endoleak after stent-graft treatment of abdominal aortic aneurysm: a meta-analysis of clinical studies. Br J Surg. 1999 May;86(5):581-7.[147]Veith FJ, Baum RA, Ohki T, et al. Nature and significance of endoleaks and endotension: summary of opinions expressed at an international conference. J Vasc Surg. 2002 May;35(5):1029-35. 这并不是开放修复术后的并发症。
术后监测可以检测到主要内漏和动脉瘤囊扩张。
EVAR 后出现内漏的风险为 24%。[146]Schurink GW, Aarts NJ, vanBockel JH. Endoleak after stent-graft treatment of abdominal aortic aneurysm: a meta-analysis of clinical studies. Br J Surg. 1999 May;86(5):581-7. 内漏主要有 5 种分型。
I 型:
附着部位内漏(腔内移植物或髂动脉封堵器的近端或远端);通常立即出现,也可能迟发。 [Figure caption and citation for the preceding image starts]: I 型内漏,位于左侧髂动脉远端吻合处(渗漏已圈出)密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
[Figure caption and citation for the preceding image starts]: I 型内漏,位于左侧髂动脉远端吻合处(渗漏已圈出)密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
在完成手术前,应尽一切努力修复 I 型内漏(例如近端密封区域的球囊模制、放置近端套囊和内缝合器 [endostaple])。持久性 IA 型内漏可能需要先进行转换才能进行开放修复术。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext [Figure caption and citation for the preceding image starts]: 支架的延长同样用于 I 型内漏(已圈出)密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
[Figure caption and citation for the preceding image starts]: 支架的延长同样用于 I 型内漏(已圈出)密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends]. [Figure caption and citation for the preceding image starts]: 延长后 I 型内漏消失密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
[Figure caption and citation for the preceding image starts]: 延长后 I 型内漏消失密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
II 型:
可能自发消退,但持续存在可能导致囊的生长。[148]Higashiura W, Greenberg RK, Katz E, et al. Predictive factors, morphologic effects, and proposed treatment paradigm for type II endoleaks after repair of infrarenal abdominal aortic aneurysms. J Vasc Interv Radiol. 2007 Aug;18(8):975-81.
如果在 EVAR 后 1 个月增强 CT 影像发现 II 型内漏或其他异常,建议患者在术后 6 个月进行影像学复查。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
治疗仍存在争议,但如果术后 6 至 12 个月持续存在内漏或动脉瘤囊增大,以致近端和/或远端密封区域可能受到损害,则建议进行治疗。[149]Mansueto G, Cenzi D, Scuro A, et al. Treatment of type II endoleak with a transcatheter transcaval approach: results at 1-year follow-up. J Vasc Surg. 2007 Jun;45(6):1120-7.[150]Baum RA, Stavropoulos SW, Fairman RM, et al. Endoleaks after endovascular repair of abdominal aortic aneurysms. J Vasc Interv Radiol. 2003 Sep;14(9 Pt 1):1111-7.[151]Van Marrewijk CJ, Fransen G, Laheij RJ, et al. Is a type II endoleak after EVAR a harbinger of risk? Causes and outcome of open conversion and aneurysm rupture during follow-up. Eur J Vasc Endovasc Surg. 2004 Feb;27(2):128-37.[152]Harris PL, Vallabhaneni SR, Desgranges P, et al. Incidence and risk factors of late rupture, conversion, and death after endovascular repair of infrarenal aortic aneurysms: the EUROSTAR experience. J Vasc Surg. 2000 Oct;32(4):739-49.
首选治疗方案是经动脉弹簧圈栓塞,但也有使用腹腔镜结扎侧支、对囊进行直接经皮经腰穿刺术、经腰栓塞术、经腔静脉导管栓塞术进行治疗的报告。[147]Veith FJ, Baum RA, Ohki T, et al. Nature and significance of endoleaks and endotension: summary of opinions expressed at an international conference. J Vasc Surg. 2002 May;35(5):1029-35.[149]Mansueto G, Cenzi D, Scuro A, et al. Treatment of type II endoleak with a transcatheter transcaval approach: results at 1-year follow-up. J Vasc Surg. 2007 Jun;45(6):1120-7.[150]Baum RA, Stavropoulos SW, Fairman RM, et al. Endoleaks after endovascular repair of abdominal aortic aneurysms. J Vasc Interv Radiol. 2003 Sep;14(9 Pt 1):1111-7.[151]Van Marrewijk CJ, Fransen G, Laheij RJ, et al. Is a type II endoleak after EVAR a harbinger of risk? Causes and outcome of open conversion and aneurysm rupture during follow-up. Eur J Vasc Endovasc Surg. 2004 Feb;27(2):128-37.[153]Steinmetz E, Rubin BG, Sanchez LA, et al. Type II endoleak after endovascular abdominal aortic aneurysm repair: a conservative approach with selective intervention is safe and cost-effective. J Vasc Surg. 2004 Feb;39(2):306-13.[154]Baum RA, Cope C, Fairman, et al. Translumbar embolization of type 2 endoleaks after endovascular repair of abdominal aortic aneurysms. J Vasc Interv Radiol. 2001 Jan;12(1):111-6.[155]Baum RA, Carpenter JP, Golden MA, et al. Treatment of type 2 endoleaks after endovascular repair of abdominal aortic aneurysms: comparison of transarterial and translumbar techniques. J Vasc Surg. 2002 Jan;35(1):23-9.[156]Schmid R, Gurke L, Aschwanden M, et al. CT-guided percutaneous embolization of a lumbar artery maintaining a type II endoleak. J Endovasc Ther. 2002 Apr;9(2):198-202.
III 型:
组织撕裂、移植物断开、组织分解等移植物缺损导致的泄漏。[146]Schurink GW, Aarts NJ, vanBockel JH. Endoleak after stent-graft treatment of abdominal aortic aneurysm: a meta-analysis of clinical studies. Br J Surg. 1999 May;86(5):581-7.[147]Veith FJ, Baum RA, Ohki T, et al. Nature and significance of endoleaks and endotension: summary of opinions expressed at an international conference. J Vasc Surg. 2002 May;35(5):1029-35.
发现后需要行修复术(延长血管内支架移植物)。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext[150]Baum RA, Stavropoulos SW, Fairman RM, et al. Endoleaks after endovascular repair of abdominal aortic aneurysms. J Vasc Interv Radiol. 2003 Sep;14(9 Pt 1):1111-7.
IV 型:
移植物壁有孔导致的渗漏。[146]Schurink GW, Aarts NJ, vanBockel JH. Endoleak after stent-graft treatment of abdominal aortic aneurysm: a meta-analysis of clinical studies. Br J Surg. 1999 May;86(5):581-7.[147]Veith FJ, Baum RA, Ohki T, et al. Nature and significance of endoleaks and endotension: summary of opinions expressed at an international conference. J Vasc Surg. 2002 May;35(5):1029-35.
使用新型的支架移植物渗漏少见,且具有自限性。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext[150]Baum RA, Stavropoulos SW, Fairman RM, et al. Endoleaks after endovascular repair of abdominal aortic aneurysms. J Vasc Interv Radiol. 2003 Sep;14(9 Pt 1):1111-7.
V 型(内张力):
EVAR 后,囊内压力增加导致内张力增加,但 CT 延迟造影剂增强扫描不可见内漏。
内张力在新一代移植支架中较为少见。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
动脉瘤未增大的情况下,没有测量内张力的标准方法,也没有适应证治疗的共识;然而,对于动脉瘤持续扩张的特定患者,建议对增高的内张力进行治疗,防止动脉瘤破裂。[56]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.http://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext[147]Veith FJ, Baum RA, Ohki T, et al. Nature and significance of endoleaks and endotension: summary of opinions expressed at an international conference. J Vasc Surg. 2002 May;35(5):1029-35.
 球囊面罩通气的动画演示
球囊面罩通气的动画演示
 中心静脉置管的动画演示
中心静脉置管的动画演示
 女性留置导尿管的动画演示
女性留置导尿管的动画演示
 男性留置导尿管的动画演示
男性留置导尿管的动画演示
 ]
] [Figure caption and citation for the preceding image starts]: AAA 破裂的 CT 扫描密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
[Figure caption and citation for the preceding image starts]: AAA 破裂的 CT 扫描密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends]. 气管插管的动画演示
气管插管的动画演示 球囊面罩通气的动画演示
球囊面罩通气的动画演示 ]
] [Figure caption and citation for the preceding image starts]: 腔内动脉瘤修复术 (EVAR) 所用的各种血管内支架密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
[Figure caption and citation for the preceding image starts]: 腔内动脉瘤修复术 (EVAR) 所用的各种血管内支架密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends]. [Figure caption and citation for the preceding image starts]: 腔内动脉瘤修复术 (EVAR)密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
[Figure caption and citation for the preceding image starts]: 腔内动脉瘤修复术 (EVAR)密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends]. [Figure caption and citation for the preceding image starts]: I 型内漏,位于左侧髂动脉远端吻合处(渗漏已圈出)密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
[Figure caption and citation for the preceding image starts]: I 型内漏,位于左侧髂动脉远端吻合处(渗漏已圈出)密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends]. [Figure caption and citation for the preceding image starts]: 支架的延长同样用于 I 型内漏(已圈出)密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
[Figure caption and citation for the preceding image starts]: 支架的延长同样用于 I 型内漏(已圈出)密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends]. [Figure caption and citation for the preceding image starts]: 延长后 I 型内漏消失密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
[Figure caption and citation for the preceding image starts]: 延长后 I 型内漏消失密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].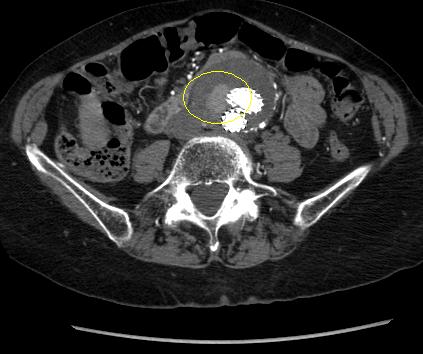 [Figure caption and citation for the preceding image starts]: 随访 CT 发现的 II 型内漏(已圈出)密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends].
[Figure caption and citation for the preceding image starts]: 随访 CT 发现的 II 型内漏(已圈出)密歇根大学 (University of Michigan),具体是血管外科和放射科 Dr Upchurch 的病例 [Citation ends]. 球囊面罩通气的动画演示
球囊面罩通气的动画演示 中心静脉置管的动画演示
中心静脉置管的动画演示 女性留置导尿管的动画演示
女性留置导尿管的动画演示 男性留置导尿管的动画演示
男性留置导尿管的动画演示