一般情况下 RCC 有不同的自然病程。整体 5 年生存率超过 68%,[21]Horner MJ, Ries LAG, Krapcho M, et al. SEER Cancer statistics review, 1975-2006. Bethesda, MD: National Cancer Institute; 2009.http://seer.cancer.gov/csr/1975_2006/但这很大程度上取决于诊断时所在分期以及确定的预后因素。转移性疾病的 5 年生存率仍然低于 10%。[23]Arsanious A, Bjarnason GA, Yousef GM. From bench to bedside: current and future applications of molecular profiling in renal cell carcinoma. Mol Canc. 2009;8:20-31.http://www.molecular-cancer.com/content/8/1/20http://www.ncbi.nlm.nih.gov/pubmed/19291329?tool=bestpractice.com晚期新靶向治疗的出现使 RCC 的治疗前景变得越来越积极。一直认为,就诊时已有症状的患者预后较差。[15]Ares Valdes Y. Correlation between symptoms and survival in patients with renal cell carcinoma. Arch Esp Urol. 2009;62:201-206.http://www.ncbi.nlm.nih.gov/pubmed/19542592?tool=bestpractice.com[16]Ou YC, Yang CR, Ho HC, et al. The symptoms of renal cell carcinoma related to patient's survival. J Chin Med Assoc. 2003;66:537-543.http://www.ncbi.nlm.nih.gov/pubmed/14649678?tool=bestpractice.com[17]Lee CT, Katz J, Fearn PA, et al. Mode of presentation of renal cell carcinoma provides prognostic information. Urol Oncol. 2002;7:135-140.http://www.ncbi.nlm.nih.gov/pubmed/12474528?tool=bestpractice.com出现副肿瘤综合征的患者的预后尤其差。[51]Gold PJ, Fefer A, Thompson JA. Paraneoplastic manifestations of renal cell carcinoma. Semin Urol Oncol. 1996;14:216-222.http://www.ncbi.nlm.nih.gov/pubmed/8946620?tool=bestpractice.com
肿瘤组织学亚型可提示不同的预后,但是在调整肿瘤分期和等级后,这一关联性就变得不显著了。一般而言,透明细胞组织学可能与较差的预后相关;此外,任何组织分型如发生肉瘤样分化则提示肿瘤侵袭性更强。[12]Delahunt B. Advances and controversies in grading and staging of renal cell carcinoma. Mod Pathol. 2009;22:S24-S36.http://www.ncbi.nlm.nih.gov/pubmed/19494851?tool=bestpractice.com总而言之,组织学作为独立的预后影响因素仍然有待研究。[177]Cheville JC, Lohse CM, Zincke H, et al. Comparisons of outcome and prognostic features among histologic subtypes of renal cell carcinoma. Am J Surg Pathol. 2003;27:612-624.http://www.ncbi.nlm.nih.gov/pubmed/12717246?tool=bestpractice.com对 RCC 生物学的不断探究极大促进了对肿瘤淋巴结转移 (TNM) 体系的重新评估,重点可能更多地强调某些病理学特点(例如肾窦浸润)。[178]Moch H, Artibani W, Delahunt B, et al. Reassessing the current UICC/AJCC TNM staging for renal cell carcinoma. Eur Urol. 2009;56:636-643.http://www.ncbi.nlm.nih.gov/pubmed/19595500?tool=bestpractice.com整体而言,病理学和临床分期以及某些患者特征均包含在预后模型中。随着对肿瘤分子特性的不断了解,将来RCC 的分类和预后模式会更加一致。
预后模型
RCC的确诊需结合影像学检查和病理结果,并对患者行临床分期及病理分期。目前已经建立了一个将这些诊断发现整合到一个包含患者其他因素在内的预后模型,该模型可能比传统分期参更好地预测生存率或预后。将分子生物学特性和生物标志物整合到预后模型中的努力仍在继续。
Memorial Sloan Kettering/Motzer 标准是被广泛应用于评估转移性病变预后的模型中的一种,且经过充分验证。最近,除了进一步验证部分 Motzer 标准外,有人进一步阐述了使用舒尼替尼、索拉非尼和贝伐单抗治疗的转移性 RCC 患者的预后标准。Heng 等人发现,低于正常下限的血红蛋白,超过正常上限 (ULN) 的矫正钙,体质指数的卡氏评分小于80%,从最初诊断到治疗的时间不到 1 年,2 处或者更多器官出现转移性疾病,超过正常上限的中性粒细胞计数以及超过正常上限的血小板计数均为独立的不良预后因素。[70]Heng DY, Xie W, Regan MM, et al. Prognostic factors for overall survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted agents: results from a large, multicenter study. J Clin Oncol. 2009;27:5794-5799.http://www.ncbi.nlm.nih.gov/pubmed/19826129?tool=bestpractice.com患者被化分成 3个不同的风险组:低风险组(无不良预后因素),该组患者未达到中位总生存率 (mOS),且 2 年总生存率(2 年 OS)为 75%,中等风险组(1 或 2个不良预后因素),该组患者的 mOS 为 27 个月,2 年 OS 为 53%,高风险组(3 到 6个不良预后因素),该组患者的 mOS 为 8.8 个月,2 年 OS 为 7%。[70]Heng DY, Xie W, Regan MM, et al. Prognostic factors for overall survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted agents: results from a large, multicenter study. J Clin Oncol. 2009;27:5794-5799.http://www.ncbi.nlm.nih.gov/pubmed/19826129?tool=bestpractice.com
国际抗癌联合会 (UICC) 和 SSIGN(梅奥)法则可用于早期局部疾病的患者和肾切除后的患者。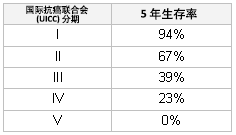 [Figure caption and citation for the preceding image starts]: 国际抗癌联合会 (UICC) 预后作者改编 Zisman 等人的内容,临床肿瘤学杂志。2001;19:1649-1657 [Citation ends].
[Figure caption and citation for the preceding image starts]: 国际抗癌联合会 (UICC) 预后作者改编 Zisman 等人的内容,临床肿瘤学杂志。2001;19:1649-1657 [Citation ends].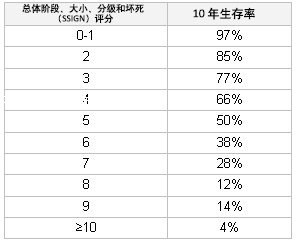 [Figure caption and citation for the preceding image starts]: 整体 SSIGN 评分所得的生存率作者改编 Frank 等人的内容,泌尿外科杂志。2002;168:2395-2400 [Citation ends].
[Figure caption and citation for the preceding image starts]: 整体 SSIGN 评分所得的生存率作者改编 Frank 等人的内容,泌尿外科杂志。2002;168:2395-2400 [Citation ends].
最初的 Motzer 标准可用于转移性 RCC 患者。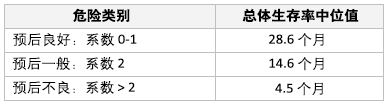 [Figure caption and citation for the preceding image starts]: Motzer 标准作者改编 Motzer 等人的内容,临床癌症研究。2004;10:6302s-6303s;以及改编 Mekhail 等人的内容,临床肿瘤学杂志。2005;23:832-841 [Citation ends].
[Figure caption and citation for the preceding image starts]: Motzer 标准作者改编 Motzer 等人的内容,临床癌症研究。2004;10:6302s-6303s;以及改编 Mekhail 等人的内容,临床肿瘤学杂志。2005;23:832-841 [Citation ends].
早期 RCC 预后
一般而言,早期疾病预后良好,5 年癌症特异性生存率超过 90%。[2]Jewett MA, Zuniga A. Renal tumor natural history: the rationale and role for active surveillance. Urol Clin North Am. 2008;35:627-634.http://www.ncbi.nlm.nih.gov/pubmed/18992616?tool=bestpractice.com与直接侵犯下腔静脉壁的患者相比,活动性癌栓患者的预后可能更好。[87]Hatcher PA, Anderson EE, Paulson DF, et al. Surgical management and prognosis of renal cell carcinoma invading the vena cava. J Urol. 1991;145:20-23.http://www.ncbi.nlm.nih.gov/pubmed/1984092?tool=bestpractice.com
随着技术的进步,手术发病率和死亡率持续下降。但是,多达 30% 的患者将出现复发伴随远处转移性疾病。在过去,对肿瘤复发可能性的预测很大程度上是依赖肿瘤分期和分化。但最近,包含了肿瘤和患者因素在内的预后模型已被证实是更为可靠的预测不良预后的手段。分子生物标志物(例如低氧诱导因子 α、碳酸酐酶 IX、pTEN、血管内皮生长因子 [VEGF])也被证实与RCC的预后密切相关。[179]Kitamura H, Tsukamoto T. Prognostic biomarkers of renal cell carcinoma: recent advances. Indian J Urol 2008;24:10-15.http://www.indianjurol.com/article.asp?issn=0970-1591;year=2008;volume=24;issue=1;spage=10;epage=15;aulast=Kitamurahttp://www.ncbi.nlm.nih.gov/pubmed/19468351?tool=bestpractice.com将分子生物标志物融合到验证过的预后模型的工作正在进行。
局部复发
充分的治愈性手术后局部复发的风险很低(大约 1.8%),[18]Ljungberg B, Hanbury DC, Kuczyk MA, et al. Renal cell carcinoma guideline. Eur Urol. 2007;51:1502-1510.http://www.ncbi.nlm.nih.gov/pubmed/17408850?tool=bestpractice.com而且不太可能在 5 内复发。对高危险患者建议每年行CT随诊,对低危险患者则进行超声随诊。但是并没有明确的证据支持这个原则。
晚期/转移性 RCC 预后
多达 30% 的接受过治愈性手术的患者将出现转移性疾病。时限各异(甚至超过 10 年),但是肿瘤复发的中位时限为肾切除术后 1.3 年。[101]de Reijke TM, Bellmunt J, van Poppel H, et al. EORTC-GU group expert opinion on metastatic renal cell cancer. Eur J Cancer. 2009;45:765-773.http://www.ncbi.nlm.nih.gov/pubmed/19157861?tool=bestpractice.com
转移性疾病的 5 年生存率低(10%),[21]Horner MJ, Ries LAG, Krapcho M, et al. SEER Cancer statistics review, 1975-2006. Bethesda, MD: National Cancer Institute; 2009.http://seer.cancer.gov/csr/1975_2006/尽管在靶向治疗方面的不断突破有望不断对转移性 RCC 人口产生积极影响。随着靶向治疗药物的引进,例如舒尼替尼,转移性 RCC 的生存率有了很大的提高(患者可达到 2 年以上的中位生存期)。[110]Motzer RJ, Hutson TE, Tomczak P, et al. Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma. J Clin Oncol. 2009;27:3584-3590.http://www.ncbi.nlm.nih.gov/pubmed/19487381?tool=bestpractice.com明确地说,证据已经表明,广泛使用舒尼替尼治疗转移性 RCC 后,总生存率几乎翻倍。[180]Heng DY, Chi KN, Murray N, et al. A population-based study evaluating the impact of sunitinib on overall survival in the treatment of patients with metastatic renal cell cancer. Cancer. 2009;115:776-783.http://www.ncbi.nlm.nih.gov/pubmed/19127560?tool=bestpractice.com虽然符合条件的和对治疗有反应的患者数量小,但是使用高剂量 IL-2使一些患者的缓解时间超过 10 年。尽管有监测,转移性 RCC 可表现生长缓慢或进展迅速;病程进展迅速的常为年轻患者。副肿瘤综合征提示较差的预后,且有显著的发病率和死亡率。
异时性转移(较迟诊断出来的复发性转移性疾病)比同时性转移(同时在其他部位诊断出来的转移)更好,且有证据支持再次转移灶切除术。[181]Hofmann HS, Neef H, Krohe K, et al. Prognostic factors and survival after pulmonary resection of metastatic renal cell carcinoma. Eur Urol. 2005;48:77-81.http://www.ncbi.nlm.nih.gov/pubmed/15967255?tool=bestpractice.com自初始诊断后无瘤间歇期长(超过 12 个月)、完全切除(肿瘤床没有残余镜下肿瘤细胞)的患者;手术切除边缘经病理 验证未见肿瘤细胞[即清除肿瘤]以及 ≤6 处转移的患者预后最佳。[182]Kavolius JP, Mastorakos DP, Pavlovich C, et al. Resection of metastatic renal cell carcinoma. J Clin Oncol. 1998;16:2261-2266.http://www.ncbi.nlm.nih.gov/pubmed/9626229?tool=bestpractice.com[181]Hofmann HS, Neef H, Krohe K, et al. Prognostic factors and survival after pulmonary resection of metastatic renal cell carcinoma. Eur Urol. 2005;48:77-81.http://www.ncbi.nlm.nih.gov/pubmed/15967255?tool=bestpractice.com切除肺部转移病变的患者的 5 年生存率范围为 30% 到 50%,[182]Kavolius JP, Mastorakos DP, Pavlovich C, et al. Resection of metastatic renal cell carcinoma. J Clin Oncol. 1998;16:2261-2266.http://www.ncbi.nlm.nih.gov/pubmed/9626229?tool=bestpractice.com[183]Piltz S, Meimarakis G, Wichmann MW, et al. Long-term results after pulmonary resection of renal cell carcinoma metastases. Ann Thorac Surg. 2002;73:1082-1087.http://www.ncbi.nlm.nih.gov/pubmed/11996245?tool=bestpractice.com[181]Hofmann HS, Neef H, Krohe K, et al. Prognostic factors and survival after pulmonary resection of metastatic renal cell carcinoma. Eur Urol. 2005;48:77-81.http://www.ncbi.nlm.nih.gov/pubmed/15967255?tool=bestpractice.com肺切除的患者 10 年生存率高达 33%。[183]Piltz S, Meimarakis G, Wichmann MW, et al. Long-term results after pulmonary resection of renal cell carcinoma metastases. Ann Thorac Surg. 2002;73:1082-1087.http://www.ncbi.nlm.nih.gov/pubmed/11996245?tool=bestpractice.com
 [Figure caption and citation for the preceding image starts]: 国际抗癌联合会 (UICC) 预后作者改编 Zisman 等人的内容,临床肿瘤学杂志。2001;19:1649-1657 [Citation ends].
[Figure caption and citation for the preceding image starts]: 国际抗癌联合会 (UICC) 预后作者改编 Zisman 等人的内容,临床肿瘤学杂志。2001;19:1649-1657 [Citation ends]. [Figure caption and citation for the preceding image starts]: 整体 SSIGN 评分所得的生存率作者改编 Frank 等人的内容,泌尿外科杂志。2002;168:2395-2400 [Citation ends].
[Figure caption and citation for the preceding image starts]: 整体 SSIGN 评分所得的生存率作者改编 Frank 等人的内容,泌尿外科杂志。2002;168:2395-2400 [Citation ends]. [Figure caption and citation for the preceding image starts]: Motzer 标准作者改编 Motzer 等人的内容,临床癌症研究。2004;10:6302s-6303s;以及改编 Mekhail 等人的内容,临床肿瘤学杂志。2005;23:832-841 [Citation ends].
[Figure caption and citation for the preceding image starts]: Motzer 标准作者改编 Motzer 等人的内容,临床癌症研究。2004;10:6302s-6303s;以及改编 Mekhail 等人的内容,临床肿瘤学杂志。2005;23:832-841 [Citation ends].