急性充血性心力衰竭 (CHF) 治疗的主要目标是缓解症状。
初始治疗包括吸氧、利尿剂、超滤、血管扩张剂、正性肌力药物和升压药的联合应用。[1]Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Eur J Heart Fail. 2016 Aug;18(8):891-975.http://eurheartj.oxfordjournals.org/content/early/2016/05/19/eurheartj.ehw128http://www.ncbi.nlm.nih.gov/pubmed/27207191?tool=bestpractice.com 其他可能的疗法包括超滤、机械通气(非侵入性和气管插管术)以及机械支持(主动脉内球囊反搏、心室辅助装置)。[1]Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Eur J Heart Fail. 2016 Aug;18(8):891-975.http://eurheartj.oxfordjournals.org/content/early/2016/05/19/eurheartj.ehw128http://www.ncbi.nlm.nih.gov/pubmed/27207191?tool=bestpractice.com
缺乏支持使用吗啡静脉注射来治疗呼吸困难的证据,并且数据显示可能出现不良反应。因此,目前建议不应对急性心力衰竭患者常规使用吗啡。[9]Ezekowitz JA, O'Meara E, McDonald MA, et al. 2017 comprehensive update of the Canadian Cardiovascular Society guidelines for the management of heart failure. Can J Cardiol. 2017 Nov;33(11):1342-1433.https://www.onlinecjc.ca/article/S0828-282X(17)30973-X/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/29111106?tool=bestpractice.com吗啡可用于姑息治疗,且对个体患者有帮助,因为其具有血管扩张剂的作用,并且可以减弱交感神经激动;然而,使用此药物应保持谨慎,因为它可能引起呼吸抑制,从而可能增加机械通气的可能性。
所有患者均应该被收入院治疗。如果患者接受初始治疗的效果良好,可以进行遥测。低血压或初始治疗无效的患者需要收住重症监护病房,如果组织灌注受损,可能需要进行有创监测。[48]McKelvie RS, Benedict CR, Yusuf S. Evidence based cardiology: prevention of congestive heart failure and management of asymptomatic left ventricular dysfunction. BMJ. 1999 May 22;318(7195):1400-2.http://www.ncbi.nlm.nih.gov/pubmed/10334754?tool=bestpractice.com 如果出现心原性休克,侵入性评估是必需的。
急性充血性心力衰竭患者应接受潜在诱因的评估,包括心肌缺血、心律失常(通常为房颤)、潜在的瓣膜病、高血压控制不佳、贫血、甲状腺疾病及药物相互作用。 其它伴随疾病,如肺炎和肺栓塞,也可能是促发因素。
建议所有患行预防静脉血栓治疗。 低分子量肝素、低剂量普通肝素或磺达肝素都可使用。 存在抗凝禁忌的患者,应使用机械设备(间歇加压装置或分级弹力袜)。
血氧饱和度维持
建议对毛细血管氧饱和度<90% 或 PaO₂<60 mmHg (8.0 kPa) 的患者进行高流量吸氧,以纠正低氧血症。[1]Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Eur J Heart Fail. 2016 Aug;18(8):891-975.http://eurheartj.oxfordjournals.org/content/early/2016/05/19/eurheartj.ehw128http://www.ncbi.nlm.nih.gov/pubmed/27207191?tool=bestpractice.com
如果不能单独依靠吸氧维持氧饱和度,则可能需要无创正压通气 (non-invasive positive pressure ventilation, NIPPV) 或持续正压通气,并且此类通气可以减少插管和机械通气的需要。[49]Nieminen MS, Bohm M, Cowie MR, et al. Executive summary of the guidelines on the diagnosis and treatment of acute heart failure: the Task Force on Acute Heart Failure of the European Society of Cardiology. Eur Heart J. 2005 Feb;26(4):384-416.http://eurheartj.oxfordjournals.org/cgi/content/full/26/4/384http://www.ncbi.nlm.nih.gov/pubmed/15681577?tool=bestpractice.com
机械通气只在其他治疗(包括无创通气方法)无效时使用。
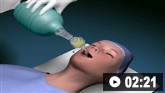 气管插管的动画演示
气管插管的动画演示
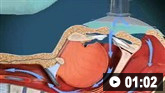 球囊面罩通气的动画演示
球囊面罩通气的动画演示
血流动力学稳定
利尿剂和血管扩张剂
髓袢利尿剂是主要治疗方法,能有效地缓解症状。[53]Felker GM, Lee KL, Bull DA, et al. Diuretic strategies in patients with acute decompensated heart failure. N Engl J Med. 2011 Mar 3;364(9):797-805.http://www.ncbi.nlm.nih.gov/pubmed/21366472?tool=bestpractice.com 如果有单独使用袢利尿剂的治疗反应不佳,可以加用非袢利尿剂,如螺内酯及美托拉宗。 静脉使用利尿剂适用于肺充血和容量过度负荷患者。[1]Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Eur J Heart Fail. 2016 Aug;18(8):891-975.http://eurheartj.oxfordjournals.org/content/early/2016/05/19/eurheartj.ehw128http://www.ncbi.nlm.nih.gov/pubmed/27207191?tool=bestpractice.com 有充血症状和体征的所有患者不论左心室射血分数如何都应接受利尿剂。在左心室射血分数降低的患者中,利尿剂应只与 ACEI(或血管紧张素 Ⅱ 受体拮抗剂)、β 受体阻滞剂以及醛固酮拮抗剂联合使用。
用于治疗急性心力衰竭和充血的髓袢利尿剂包括呋塞米、布美他尼和托拉塞米。 最常用的药物似乎是呋塞米,但是一些患者可能对其他髓袢利尿剂(例如布美他尼、托拉塞米)的反应更好。 最初在住院治疗时,通常使用静脉内药剂(推注或持续输注)。
在产生抵抗的病例中,髓袢利尿剂应与螺内酯或美托拉宗等噻嗪类利尿剂联合使用。 有必要仔细监测这些患者的肾功能和电解质。 应当使用最低剂量的利尿剂缓解充血、保持患者无症状并保持干体重。
对于病情稳定的充血性心力衰竭患者,袢利尿剂是首选药物。对于高血压和仅轻度液体潴留的患者,可考虑使用噻嗪类利尿剂,但几乎所有急性心力衰竭的患者都需要髓袢利尿剂。
血管扩张剂 [硝酸甘油、硝普钠和奈西立肽 (nesiritide)] 适用于肺充血/水肿和收缩压>90 mmHg 的患者。[1]Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Eur J Heart Fail. 2016 Aug;18(8):891-975.http://eurheartj.oxfordjournals.org/content/early/2016/05/19/eurheartj.ehw128http://www.ncbi.nlm.nih.gov/pubmed/27207191?tool=bestpractice.com 硝酸甘油是一线药物,考虑奈西立肽 (nesiritide) 为二线药物。[54]O'Connor CM, Starling RC, Hernandez AF, et al. Effect of nesiritide in patients with acute decompensated heart failure. N Engl J Med. 2011 Jul 7;365(1):32-43.http://www.ncbi.nlm.nih.gov/pubmed/21732835?tool=bestpractice.com
尽管没有大规模的研究将单独使用利尿剂与使用硝酸甘油治疗急性充血性心力衰竭的疗效进行对比,但有一些研究认为,单用硝酸酯类药物可能是急性充血性心力衰竭患者的更好选择。[55]Northridge D. Frusemide or nitrates for acute heart failure? Lancet. 1996 Mar 9;347(9002):667-8.http://www.ncbi.nlm.nih.gov/pubmed/8596385?tool=bestpractice.com 在临床实践中,这两种药物可联合使用。临床结局:有中等质量的证据表明,对于严重肺水肿患者,相较于大剂量呋塞米联合小剂量硝酸酯类药物,小剂量呋塞米之后静脉使用大剂量硝酸酯类药物能更好地减少对机械通气的需求,降低心肌梗死的发生率。[56]Cotter G, Metzkor E, Kaluski E, et al. Randomised trial of high-dose isosorbide dinitrate plus low-dose furosemide versus high-dose furosemide plus low-dose isosorbide dinitrate in severe pulmonary oedema. Lancet. 1998 Feb 7;351(9100):389-93.http://www.ncbi.nlm.nih.gov/pubmed/9482291?tool=bestpractice.com受试者<200名的随机对照临床试验(RCT)、受试者>200名且方法学存在缺陷的随机对照临床试验(RCT)、方法学存在缺陷的系统评价或者高质量的观察性(队列)研究。 在对急性心力衰竭患者的 4 项研究分析中,硝酸酯类药物和替代性治疗干预措施对症状缓解和血流动力学变量方面的作用未见明显差异。[57]Wakai A, McCabe A, Kidney R, et al. Nitrates for acute heart failure syndromes. Cochrane Database Syst Rev. 2013 Aug 6;(8):CD005151.http://www.ncbi.nlm.nih.gov/pubmed/23922186?tool=bestpractice.com
初期治疗无效的患者,可使用体外超滤降低容量负荷。[58]Costanzo MR, Guglin ME, Saltzberg MT, et al. Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure. J Am Coll Cardiol. 2007 Feb 13;49(6):675-83.http://www.onlinejacc.org/content/49/6/675http://www.ncbi.nlm.nih.gov/pubmed/17291932?tool=bestpractice.com临床结局:有高质量的证据表明,与单独应用利尿剂相比,对急性失代偿性心力衰竭患者采用外周超滤可改善 48 小时内体重下降情况,可减少对血管活性药物的需要,并降低患者 90 天内的再住院率。[59]Hill JA, Yancy CW, Abraham WT. Beyond diuretics: management of volume overload in acute heart failure syndromes. Am J Med. 2006 Dec;119(12 Suppl 1):S37-44.http://www.ncbi.nlm.nih.gov/pubmed/17113399?tool=bestpractice.com系统评价或者受试者>200名的随机对照临床试验(RCT)。
血流动力学不稳定
低血压(即收缩压<90 mmHg)或休克患者应该使用正性肌力药物/血管加压药及机械辅助循环支持。[1]Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Eur J Heart Fail. 2016 Aug;18(8):891-975.http://eurheartj.oxfordjournals.org/content/early/2016/05/19/eurheartj.ehw128http://www.ncbi.nlm.nih.gov/pubmed/27207191?tool=bestpractice.com 然而,正性肌力药物应慎用,因为有证据显示它们会导致死亡率增加,并可能导致心律失常和加重心肌缺血。[13]Abraham WT, Adams KF, Fonarow GC, et al. In-hospital mortality in patients with acute decompensated heart failure requiring intravenous vasoactive medications: an analysis from the Acute Decompensated Heart Failure National Registry (ADHERE). J Am Coll Cardiol. 2005 Jul 5;46(1):57-64.http://www.ncbi.nlm.nih.gov/pubmed/15992636?tool=bestpractice.com 出现持续性心律失常时应中止用药。可同时适当使用胺碘酮,但是没有大规模的数据支持这种情况下使用抗心律失常药。如果患者出现有症状的冠脉缺血,应停用正性肌力药物。
患者的收缩压低于90mmHg,或平均动脉压下降超过30mmHg伴随脉率超过60bpm,和/或尿量减少(<0.5mL/kg/小时)被定义为心原性休克。 对于应用了正性肌力药物治疗仍不能纠正的持续心源性休克患者,还应考虑插入主动脉内球囊反搏 (IABP)。 但不适用于严重主动脉瓣反流或主动脉夹层的患者。 IABP 通常在临床上用于在手术纠正特异性急性机械问题(例如,急性二尖瓣反流、室间隔破裂)之前或在经皮或外科血管重建之前或期间支持循环。[1]Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Eur J Heart Fail. 2016 Aug;18(8):891-975.http://eurheartj.oxfordjournals.org/content/early/2016/05/19/eurheartj.ehw128http://www.ncbi.nlm.nih.gov/pubmed/27207191?tool=bestpractice.com 然而,一项试验显示,IABP 对患有心源性休克、并发急性心肌梗死并进行血运重建的患者没有益处。[60]Thiele H, Zeymer U, Neumann FJ, et al. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med. 2012 Oct 4;367(14):1287-96.http://www.nejm.org/doi/full/10.1056/NEJMoa1208410#t=articlehttp://www.ncbi.nlm.nih.gov/pubmed/22920912?tool=bestpractice.com 在这项研究中,排除了机械原因导致心源性休克(例如,室间隔缺损或乳头肌断裂)的患者。[60]Thiele H, Zeymer U, Neumann FJ, et al. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med. 2012 Oct 4;367(14):1287-96.http://www.nejm.org/doi/full/10.1056/NEJMoa1208410#t=articlehttp://www.ncbi.nlm.nih.gov/pubmed/22920912?tool=bestpractice.com 因此,通常不建议使用 IABP 治疗心源性休克。
正性肌力药物的选择取决于临床表现。 建议收缩压在 85-100 mmHg 的患者使用多巴酚丁胺或米力农。[49]Nieminen MS, Bohm M, Cowie MR, et al. Executive summary of the guidelines on the diagnosis and treatment of acute heart failure: the Task Force on Acute Heart Failure of the European Society of Cardiology. Eur Heart J. 2005 Feb;26(4):384-416.http://eurheartj.oxfordjournals.org/cgi/content/full/26/4/384http://www.ncbi.nlm.nih.gov/pubmed/15681577?tool=bestpractice.com 建议收缩压<85 mmHg 的患者使用多巴胺和/或降肾上腺素(去甲肾上腺素)。[49]Nieminen MS, Bohm M, Cowie MR, et al. Executive summary of the guidelines on the diagnosis and treatment of acute heart failure: the Task Force on Acute Heart Failure of the European Society of Cardiology. Eur Heart J. 2005 Feb;26(4):384-416.http://eurheartj.oxfordjournals.org/cgi/content/full/26/4/384http://www.ncbi.nlm.nih.gov/pubmed/15681577?tool=bestpractice.com 左西孟旦属于钙增敏剂,是一种新型药物,有时也建议将其作为多巴酚丁胺或米力农的替代药物;但它实际临床工作中并不常用,而且在一些国家(包括美国)可能没有这种药物。[61]Follath F, Cleland JG, Just H, et al; Steering Committee and Investigators of the Levosimendan Infusion versus Dobutamine (LIDO) Study. Efficacy and safety of intravenous levosimendan compared with dobutamine in severe low-output heart failure (the LIDO study): a randomised double-blind trial. Lancet. 2002 Jul 20;360(9328):196-202.http://www.ncbi.nlm.nih.gov/pubmed/12133653?tool=bestpractice.com[62]Mebazaa A, Nieminen MS, Packer M, et al. Levosimendan vs dobutamine for patients with acute decompensated heart failure: the SURVIVE randomized trial. JAMA. 2007 May 2;297(17):1883-91.http://www.ncbi.nlm.nih.gov/pubmed/17473298?tool=bestpractice.com[63]Parissis JT, Andreadou I, Bistola V, et al. Novel biologic mechanisms of levosimendan and its effect on the failing heart. Expert Opin Investig Drugs. 2008 Aug;17(8):1143-50.http://www.ncbi.nlm.nih.gov/pubmed/18616411?tool=bestpractice.com[64]Bergh CH, Andersson B, Dahlström U, et al. Intravenous levosimendan vs. dobutamine in acute decompensated heart failure patients on beta-blockers. Eur J Heart Fail. 2010 Apr;12(4):404-10.http://onlinelibrary.wiley.com/doi/10.1093/eurjhf/hfq032/fullhttp://www.ncbi.nlm.nih.gov/pubmed/20335355?tool=bestpractice.com
一般情况下,可考虑将升压药(如多巴胺或去甲肾上腺素)用于正性肌力药物治疗(如多巴酚丁胺)无效的患者。 正性肌力药物和升压药都会引起心动过速,并可能诱发心肌缺血和心律失常。 建议在输注正性肌力药物的过程中,持续监测心律。
不推荐使用正性肌力药物,除非患者出现低血压(即收缩压<90 mmHg)、低灌注或休克症状。[1]Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Eur J Heart Fail. 2016 Aug;18(8):891-975.http://eurheartj.oxfordjournals.org/content/early/2016/05/19/eurheartj.ehw128http://www.ncbi.nlm.nih.gov/pubmed/27207191?tool=bestpractice.com
对静脉使用利尿剂的急性心力衰竭和肾功能不全患者,加用低剂量的多巴胺或奈西立肽并不能改善利尿、减轻充血或改善肾功能。[65]Chen HH, Anstrom KJ, Givertz MM, et al. Low-dose dopamine or low-dose nesiritide in acute heart failure with renal dysfunction: the ROSE acute heart failure randomized trial. JAMA. 2013 Dec 18;310(23):2533-43.http://jama.jamanetwork.com/article.aspx?articleid=1779722http://www.ncbi.nlm.nih.gov/pubmed/24247300?tool=bestpractice.com
潜在病因的特殊治疗
冠状动脉病
静脉使用硝酸甘油为一线治疗。
硝酸甘油常见的副作用是头痛和低血压。 如果收缩压下降至90~100mmHg以下,硝酸酯的剂量应减少,如果血压进一步下降,应停止用药。
对于严重冠状动脉病变引起急性充血性心力衰竭的病例,应进行经皮冠脉血运重建术或冠状动脉旁路移植术。对于所有冠状动脉缺血和接受血运重建的患者,应使用阿司匹林。
对于急性心肌梗死导致的心原性休克病例,应进行血运重建。 溶栓在这种情况下疗效不明显。[66]O'Gara PT, Kushner FG, Ascheim DD, et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013 Jul 1;82(1):E1-27.http://circ.ahajournals.org/content/127/4/e362.longhttp://www.ncbi.nlm.nih.gov/pubmed/23247304?tool=bestpractice.com
高血压急症
瓣膜性心脏病
在重度主动脉瓣狭窄伴心力衰竭的病例中,如果患者血压不低,可以使用硝普钠。[67]Khot UN, Novaro GM, Popovic ZB, et al. Nitroprusside in critically ill patients with left ventricular dysfunction and aortic stenosis. N Engl J Med. 2003 May 1;348(18):1756-63.http://www.nejm.org/doi/full/10.1056/NEJMoa022021#t=articlehttp://www.ncbi.nlm.nih.gov/pubmed/12724481?tool=bestpractice.com
有效治疗主动脉瓣狭窄或二尖瓣狭窄的方法是瓣膜置换术,但在瓣膜置换前,可将经皮瓣膜成形术作为治疗心力衰竭的临时措施。 如果经食管超声波心动图(TOE)未显示血栓,则可通过经皮瓣膜成形术治疗二尖瓣狭窄。
跟与二尖瓣返流或主动脉瓣返流相关的心力衰竭相似,应使用血管扩张药物,如硝普钠。 外周动脉阻力下降会导致心输出量增加和返流量减少,这反过来也有助于减少左室舒张末容积和增加左室射血分数。
急性右心衰竭
治疗围绕潜在病理进行;例如肺栓塞(抗凝、溶栓剂、导管插入或外科血栓切除术)、右心室梗死(PCI 或溶栓剂)及慢性血栓栓塞性肺动脉高血压(血栓动脉内膜切除术)。[68]Lahm T, McCaslin CA, Wozniak TC, et al. Medical and surgical treatment of acute right ventricular failure. J Am Coll Cardiol. 2010 Oct 26;56(18):1435-46.http://www.ncbi.nlm.nih.gov/pubmed/20951319?tool=bestpractice.com
急性心肌炎
巨细胞性心肌炎可使用单一或联合免疫抑制剂进行治疗,包括皮质类固醇、硫唑嘌呤、环孢素和莫罗单抗-CD3 (OKT3)。[69]Cooper LT Jr, Berry GJ, Shabetai R. Idiopathic giant-cell myocarditis - natural history and treatment. Multicenter Giant Cell Myocarditis Study Group Investigators. N Engl J Med. 1997 Jun 26;336(26):1860-6.http://www.nejm.org/doi/full/10.1056/NEJM199706263362603#t=articlehttp://www.ncbi.nlm.nih.gov/pubmed/9197214?tool=bestpractice.com
其他类型的心肌炎治疗仅限于支持性治疗。[70]Lindenfeld J, Albert NM, Boehmer JP, et al. Heart Failure Society of America 2010 comprehensive heart failure practice guideline. J Card Fail. 2010 Jun;16(6):e1-194.http://www.ncbi.nlm.nih.gov/pubmed/20610207?tool=bestpractice.com
药物治疗抵抗
在对最大剂量药物疗法产生了抵抗的患者中,应植入左心室辅助设备 (LVAD)。[71]Peura JL, Colvin-Adams M, Francis GS, et al; American Heart Association. Recommendations for the use of mechanical circulatory support: device strategies and patient selection: a scientific statement from the American Heart Association. Circulation. 2012 Nov 27;126(22):2648-67.http://circ.ahajournals.org/content/126/22/2648.longhttp://www.ncbi.nlm.nih.gov/pubmed/23109468?tool=bestpractice.com 在一些非缺血性心肌病病例中,植入 LVAD 可持续逆转重度心力衰竭症状。[72]Birks EJ, Tansley PD, Hardy J, et al. Left ventricular assist device and drug therapy for the reversal of heart failure. N Engl J Med. 2006 Nov 2;355(18):1873-84.http://www.nejm.org/doi/full/10.1056/NEJMoa053063#t=articlehttp://www.ncbi.nlm.nih.gov/pubmed/17079761?tool=bestpractice.com 在过去25年,左心室辅助装置已有显著发展,现已出现各类左心室辅助装置。 体外装置中最常见的是体外膜式氧合器(ECMO),需要完全肝素化,通常使用数天或数周,可作为有望在几天内恢复的患者的过渡工具。 临时装置(如TandemHeart)经股动脉插入,并送入左心室。 较长期辅助装置分成第一代(如HeartMateI)、第二代(如HeartMateII)和第三代(如HVAD和DuraHeart)设备。 第三代泵装置被认为可持续使用 5-10 年,目前正在一些第 1 阶段研究中进行评估。[73]Terracciano CM, Miller LW, Yacoub MH. Contemporary use of ventricular assist devices. Annu Rev Med. 2010;61:255-70.http://www.ncbi.nlm.nih.gov/pubmed/20059338?tool=bestpractice.com
正在进行治疗
一旦患者病情稳定,应考虑开始心力衰竭的确定性治疗。通常首先使用 ACE 抑制剂(或者,如果不耐受 ACE 抑制剂,则使用血管紧张素 Ⅱ 受体拮抗剂), [  ]How do angiotensin receptor blockers (ARBs) affect outcomes in people with heart failure?https://cochranelibrary.com/cca/doi/10.1002/cca.298/full显示答案 然后加用 β 受体阻滞剂。血管紧张素转换酶抑制剂和 β 受体阻滞剂的剂量应根据血压和心率,增至最大耐受剂量。有持续容量超负荷体征的患者需继续使用利尿剂。对于采用这些治疗后仍存在持续症状的患者,应视为有慢性充血性心力衰竭而进行治疗。对于左心室射血分数 (LVEF) 降低的患者,应开具醛固酮受体拮抗剂治疗处方。[32]Yancy CW, Jessup M, Bozkurt B, et al. 2017 ACC/AHA/HFSA focused update of the 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. Circulation. 2017 Aug 8;136(6):e137-61.http://circ.ahajournals.org/content/early/2017/04/26/CIR.0000000000000509http://www.ncbi.nlm.nih.gov/pubmed/28455343?tool=bestpractice.com
]How do angiotensin receptor blockers (ARBs) affect outcomes in people with heart failure?https://cochranelibrary.com/cca/doi/10.1002/cca.298/full显示答案 然后加用 β 受体阻滞剂。血管紧张素转换酶抑制剂和 β 受体阻滞剂的剂量应根据血压和心率,增至最大耐受剂量。有持续容量超负荷体征的患者需继续使用利尿剂。对于采用这些治疗后仍存在持续症状的患者,应视为有慢性充血性心力衰竭而进行治疗。对于左心室射血分数 (LVEF) 降低的患者,应开具醛固酮受体拮抗剂治疗处方。[32]Yancy CW, Jessup M, Bozkurt B, et al. 2017 ACC/AHA/HFSA focused update of the 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. Circulation. 2017 Aug 8;136(6):e137-61.http://circ.ahajournals.org/content/early/2017/04/26/CIR.0000000000000509http://www.ncbi.nlm.nih.gov/pubmed/28455343?tool=bestpractice.com
左心室射血分数低的患者,应开始采用ACE抑制剂、β受体阻滞剂和醛固酮受体拮抗剂联合治疗,并长期维持。[32]Yancy CW, Jessup M, Bozkurt B, et al. 2017 ACC/AHA/HFSA focused update of the 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. Circulation. 2017 Aug 8;136(6):e137-61.http://circ.ahajournals.org/content/early/2017/04/26/CIR.0000000000000509http://www.ncbi.nlm.nih.gov/pubmed/28455343?tool=bestpractice.com 对于射血分数降低(NYHA Ⅱ 级、Ⅲ 级、Ⅳ 级且 LVEF≤35%)的患者,以及使用 ACE 抑制剂、β 受体阻滞剂和盐皮质激素受体拮抗剂进行最佳治疗后仍有症状的患者,推荐联合使用沙库巴曲(一种脑啡肽酶抑制剂)和缬沙坦(一种血管紧张素 Ⅱ 受体拮抗剂)替代 ACE 抑制剂。[1]Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Eur J Heart Fail. 2016 Aug;18(8):891-975.http://eurheartj.oxfordjournals.org/content/early/2016/05/19/eurheartj.ehw128http://www.ncbi.nlm.nih.gov/pubmed/27207191?tool=bestpractice.com[74]McMurray JJ, Packer M, Desai AS, et al; PARADIGM-HF Investigators and Committees. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med. 2014 Sep 11;371(11):993-1004.http://www.ncbi.nlm.nih.gov/pubmed/25176015?tool=bestpractice.com 使用沙库必曲/缬沙坦治疗可通过减少心力衰竭恶化和心源性猝死来降低心血管病死亡率。[75]Desai AS, McMurray JJ, Packer M, et al. Effect of the angiotensin-receptor-neprilysin inhibitor LCZ696 compared with enalapril on mode of death in heart failure patients. Eur Heart J. 2015 Aug 7;36(30):1990-7.http://www.ncbi.nlm.nih.gov/pubmed/26022006?tool=bestpractice.com 对于射血分数下降的心力衰竭患者,与使用依那普利相比,使用沙库巴曲/缬沙坦显著改善了体力活动和社交活动。[76]Chandra A, Lewis EF, Claggett BL, et al. Effects of sacubitril/valsartan on physical and social activity limitations in patients with heart failure: a secondary analysis of the PARADIGM-HF trial. JAMA Cardiol. 2018 Jun 1;3(6):498-505.http://www.ncbi.nlm.nih.gov/pubmed/29617523?tool=bestpractice.com 左心室射血分数低的黑人患者,采用肼苯哒嗪和硝酸异山梨酯联合治疗非常有效。
在射血分数正常(舒张性心力衰竭)的患者中,对血压、心律失常和潜在缺血进行良好控制很重要。没有令人信服的证据表明哪种治疗可以降低此类患者的死亡率。一项针对 6 项前瞻性随机对照试验的 meta 分析中,针对射血分数正常的心力衰竭患者,对一系列肾素-血管紧张素抑制剂(例如培哚普利、依那普利、雷米普利、缬沙坦、坎地沙坦和厄贝沙坦)的使用进行了评估。结果显示,肾素-血管紧张素抑制剂治疗后,患者 6 分钟步行试验距离延长、生活质量提高,并且心力衰竭恶化事件减少。但它并未降低总死亡率或心血管死亡率。[77]Singh M, Shah T, Adigopula S, et al. Safety and efficacy of rennin-angiotensin system inhibitors in heart failure with preserved ejection fraction. International Journal of Collaborative Research on Internal Medicine & Public Health. 2011;3(4):295-310.http://www.iomcworld.com/ijcrimph/files/v03-n04-02.pdf
在基于指南的心力衰竭治疗的情况下,对静息心率>70 bpm 的状态稳定的慢性心力衰竭患者(即 LVEF<35%)应用伊伐布雷定治疗,其可使因心力衰竭恶化而住院治疗的风险降低。[32]Yancy CW, Jessup M, Bozkurt B, et al. 2017 ACC/AHA/HFSA focused update of the 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. Circulation. 2017 Aug 8;136(6):e137-61.http://circ.ahajournals.org/content/early/2017/04/26/CIR.0000000000000509http://www.ncbi.nlm.nih.gov/pubmed/28455343?tool=bestpractice.com[78]Borer JS, Böhm M, Ford I, et al; SHIFT Investigators. Effect of ivabradine on recurrent hospitalization for worsening heart failure in patients with chronic systolic heart failure: the SHIFT Study. Eur Heart J. 2012 Nov;33(22):2813-20.http://eurheartj.oxfordjournals.org/content/33/22/2813.longhttp://www.ncbi.nlm.nih.gov/pubmed/22927555?tool=bestpractice.com 在一项随机、双盲、安慰剂对照试验中,在无临床心力衰竭(整个研究人群中无左心室收缩功能障碍的证据,平均射血分数为 56.4%)且病情稳定的冠状动脉疾病患者的标准背景治疗中,加用伊伐布雷定并没有改善临床结局。在此研究的亚组分析中,对于加拿大心血管学会 (CCS) Ⅱ 级或更高级别心绞痛的患者,伊伐布雷定与主要终点(心血管原因或非致命性心肌梗死造成的死亡)的发生率增加相关,但对于没有心绞痛或有 Ⅰ 级心绞痛的患者,主要终点发生率没有增加。伊伐布雷定与心动过缓、QT 间期延长和心房颤动的发病率升高相关。[79]Fox K, Ford I, Steg PG, et al. Ivabradine in stable coronary artery disease without clinical heart failure. N Engl J Med. 2014 Sep 18;371(12):1091-9.http://www.nejm.org/doi/full/10.1056/NEJMoa1406430#t=articlehttp://www.ncbi.nlm.nih.gov/pubmed/25176136?tool=bestpractice.com
地高辛可显著降低 NYHA 3 级或 4 级症状、LVEF<25% 或心胸比>55%、非卧床的慢性心力衰竭患者的死亡率或住院治疗的复合终点风险,因此在上述患者中应考虑使用。[80]Gheorghiade M, Patel K, Filippatos G, et al. Effect of oral digoxin in high-risk heart failure patients: a pre-specified subgroup analysis of the DIG trial. Eur J Heart Fail. 2013 May;15(5):551-9.http://onlinelibrary.wiley.com/doi/10.1093/eurjhf/hft010/fullhttp://www.ncbi.nlm.nih.gov/pubmed/23355060?tool=bestpractice.com 对于窦性心律的心力衰竭患者,地高辛的使用对死亡率没有影响,但其与住院率和临床恶化发生率降低相关。[81]Hood WB Jr, Dans AL, Guyatt GH, et al. Digitalis for treatment of heart failure in patients in sinus rhythm. Cochrane Database Syst Rev. 2014 Apr 28;(4):CD002901.http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD002901.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/24771511?tool=bestpractice.com
 气管插管的动画演示
气管插管的动画演示 球囊面罩通气的动画演示
球囊面罩通气的动画演示 ] 然后加用 β 受体阻滞剂。血管紧张素转换酶抑制剂和 β 受体阻滞剂的剂量应根据血压和心率,增至最大耐受剂量。有持续容量超负荷体征的患者需继续使用利尿剂。对于采用这些治疗后仍存在持续症状的患者,应视为有慢性充血性心力衰竭而进行治疗。对于左心室射血分数 (LVEF) 降低的患者,应开具醛固酮受体拮抗剂治疗处方。[32]
] 然后加用 β 受体阻滞剂。血管紧张素转换酶抑制剂和 β 受体阻滞剂的剂量应根据血压和心率,增至最大耐受剂量。有持续容量超负荷体征的患者需继续使用利尿剂。对于采用这些治疗后仍存在持续症状的患者,应视为有慢性充血性心力衰竭而进行治疗。对于左心室射血分数 (LVEF) 降低的患者,应开具醛固酮受体拮抗剂治疗处方。[32]