病因学
吸烟是膀胱癌最重要的致病因素,可使膀胱癌的风险增加 2-4 倍。约一半的男性病例和三分之一的女性病例的致病因素为吸烟。[23] 二手烟;职业暴露于化学致癌物,例如橡胶和染料行业的芳香胺类,铝、煤和屋面行业的多环芳烃;以及暴露于饮用水中的砷。这些因素约占四分之一或以上的病例。[24] 其他风险较高的职业群体包括画家、美发师,甚至是医疗和文职人员。盆腔放疗(常用于前列腺癌)和化疗(例如环磷酰胺)可显著增加膀胱癌风险。[25][26]
2 型糖尿患者发生膀胱癌的风险可能略有增加。[27][28] 有一些证据表明,2 型糖尿病成人患者使用吡格列酮(一种噻唑烷二酮)可增加膀胱癌风险。[29] 相比之下,多项研究表明,使用二甲双胍治疗糖尿病前期或 2 型糖尿病可实际降低癌症的发病率和死亡率,并提高化疗和放疗的疗效。[30]
慢性炎症、血吸虫感染以及长期留置尿管增加膀胱鳞状细胞癌风险。也有膀胱癌的家族性病例,但尚未确定特定基因。
病理生理学
一些致癌物(例如亚硝胺)在尿液中浓缩和排出,从而使得尿路上皮细胞暴露于致癌物中。膀胱处的暴露(其中 95% 的尿路上皮癌出现于此)时间较长,但恶变可出现在尿路的任何地方,从肾盏到尿道口。[31]
多灶性和同时发生的肿瘤见于 70% 的新诊断病例,而 50% 以上的病例存在异型增生区域,甚至是原位癌(无论是癌旁还是远端区域)。异时性复发见于 60% 以上的患者,常位于距原发部位较远的部位。这些发现导致了“场效应”这一概念的产生,尿道上皮暴露于大致相同浓度的致癌剂会产生一种上皮细胞,自此开始,偶有细胞被启动,发展为独立克隆的转化细胞。随后的进一步变化可能产生同时性或异时性多灶肿瘤。
虽然“场效应”被认为可解释膀胱癌多灶性现象,但 X 染色体失活研究显示,大多数肿瘤起源于单个细胞。[32] 但是,这两种概念均具有临床实用性:点突变可启动进程,赋予细胞生长优势,以便后期发展为恶性表型,这也许可解释新发肿瘤的临近性,以及上尿路肿瘤细胞下行植入和切除术后植入的现象。
参与化学解毒作用的基因(例如编码谷胱甘肽 S-转移酶 M1 和 N-乙酰转移酶的基因)在膀胱癌的发生发展中起到一定作用。在人体细胞中,在膀胱癌细胞系中首次发现癌基因 (ras),但 ras 和其他显性基因很少受累。9号染色体长臂 (9q) 中杂合性的缺失常见于有良好预后的非浸润性肿瘤,而抑癌基因 Rb 和 p53 的缺失与浸润性肿瘤和不良预后有关。[31] 肌层浸润性尿路上皮癌的腔内和基底基因表达与乳腺癌的并无不同。[33]
分类
TNM 分类[1]
基于活检结果、体格检查和影像学检查结果,依据浸润水平对膀胱肿瘤进行分期。最广泛使用且被普遍接受的分期系统为肿瘤 - 淋巴结 - 转移 (tumour-node-metastases, TNM) 系统。
T:原发性肿瘤
TX:无法评估原发性肿瘤
T0:无原发性肿瘤的证据
Ta:非浸润性乳头状癌
Tis:原位癌:“扁平瘤”
T1:肿瘤侵及上皮下结缔组织(黏膜固有层)
T2:肿瘤侵犯固有肌层:
T2a:肿瘤侵及固有肌层浅层(内侧半层)
T2b:肿瘤侵及固有肌层深层(外侧半层)
T3:肿瘤侵及膀胱周围组织:
T3a:显微镜下可见
T3b:肉眼可见(膀胱外肿块)
T4:肿瘤侵及以下任何部位:前列腺间质、精囊、子宫、阴道、盆壁、腹壁
T4a:肿瘤侵及前列腺间质、子宫或阴道
T4b:肿瘤侵及盆壁或腹壁。
N:淋巴结
NX:无法评估局部淋巴结
N0:无局部淋巴结转移
N1:真骨盆内单个淋巴结转移(下腹、闭孔、髂外或骶骨前)
N2:真骨盆内多个局部淋巴结转移(下腹、闭孔、髂外或骶骨前)
N3:髂总淋巴结转移
M:远处转移
M0:无远处转移
M1a:非区域淋巴结转移(多发)
M1b:其他远处转移。
按照这个分级系统,非肌层浸润性膀胱癌包括:
局限于上皮粘膜的乳头状瘤(Ta 期)
 [Figure caption and citation for the preceding image starts]: 低分级非浸润性 (Ta) 乳头状尿路上皮癌;注意邻近卫星灶,表明存在场效应 (field effect)(图片)由 Donald Lamm, MD, FACS 提供 [Citation ends].
[Figure caption and citation for the preceding image starts]: 低分级非浸润性 (Ta) 乳头状尿路上皮癌;注意邻近卫星灶,表明存在场效应 (field effect)(图片)由 Donald Lamm, MD, FACS 提供 [Citation ends].侵及上皮下组织(即固有层;T1)的肿瘤
Tis(原位癌)。
WHO 分级[2]
还必须根据肿瘤的细胞特征对其进行分级。过去根据 1973 年世界卫生组织 (World Health Organization, WHO) 尿路上皮乳头状肿瘤分级将膀胱癌分为高分化 (G1)、中分化 (G2) 或低分化 (G3) 肿瘤。
2004 年,WHO 和国际泌尿病理协会 (International Society of Urological Pathology, ISUP) 公布了一项新的分级系统,该系统采用了特定的细胞学和组织结构标准。[3][4][5] 新的 WHO/ISUP 分类将低恶性可能性的乳头状尿路上皮瘤以及低级别和高级别的尿路上皮瘤区分开来。在过去,许多病理学家将 Ta 期 G1 级别的肿瘤描述为非浸润性乳头状癌。因此,并不确定这些肿瘤是恶性还是良性的。为让全球范围内表述更为一致,WHO 现将这些肿瘤描述为低恶性可能性的乳头状尿路上皮瘤 (papillary urothelial neoplasms of low malignant potential, PUNLMP)。
与 2004 年一样,2016 年 WHO 分类继续推荐使用 ISUP 于 1997 年首次发布的分级分类标准。[2] 对恶性可能性未定的尿路上皮增殖(增生)和尿路上皮发育异常的分级提供了更详细的描述和定义。[2] 尽管 WHO 分级系统现已更新,但仍继续使用这两个较旧的分级系统。[6]
1973 年和 2004 年分级系统的比较:[3][4][5]
1973 年 WHO 分级
尿路上皮乳头状瘤
1 级:高度分化,具有成形的乳头状结构、正常染色质以及少量核仁或有丝分裂
2 级:中度分化,通常具有乳头状结构、颗粒染色质以及核仁和有丝分裂增加
3 级:低度分化,通常不具有乳头状结构,具有粗糙染色质,并可见许多核仁和有丝分裂。
2004 年 WHO/ISUP 分级
尿路上皮乳头状瘤
低恶性倾向尿路上皮乳头状瘤 (papillary urothelial neoplasm of low malignant potential, PUNLMP)
低分级乳头状尿路上皮癌
高分级乳头状尿路上皮癌。
使用 2004 年 WHO/ISUP 分类将使肿瘤的诊断更趋一致,根据风险可能性将肿瘤更好地进行分层。然而,欧洲泌尿协会 (European Association of Urology, EAU) 关于非肌层浸润性疾病的指南建议,1973 年和 2004 年 WHO 分类均应用于肿瘤分级,直至 2004 年分类系统在更多的临床试验中得到验证。[7][8]
证据表明,与 1973 年 WHO 分类系统相比,2004 年 WHO/ISUP 分类并未提高非肌层浸润性肿瘤的观察者间可重复性。[9] 2004 年 PUNLMP 分类的可重复性极低 (50%)。然而,使用 2004 年分类系统区分低级别和高级别尿路上皮癌时,有较高的观察者间重复性 (84%-90%)。[10][11]
按照 WHO 1973 年分级方法诊断为 1 级癌的部分病例被重新划分到 PUNLMP 类,而另外一部分则被重新划分为低分级癌类(WHO 2004 年分级)。同样地,按照WHO 1973 年分级方法诊断为 2 级癌的部分病例被重新划分到低分级癌类,而另外一部分则被重新划分为高分级癌类(WHO 2004 年分级)。按照 WHO 1973 年分级方法诊断为 3 级癌的所有病例被归类为高分级癌(WHO 2004 年分级)。
膀胱癌的准确分期和分级对正确诊断、治疗和随访必不可少。癌症分期和分级可提示复发的可能性以及进展至浸润性癌的风险。 [Figure caption and citation for the preceding image starts]: 低分级非浸润性 (Ta) 乳头状尿路上皮癌;注意邻近卫星灶,表明存在场效应 (field effect)(图片)由 Donald Lamm, MD, FACS 提供 [Citation ends].
[Figure caption and citation for the preceding image starts]: 低分级非浸润性 (Ta) 乳头状尿路上皮癌;注意邻近卫星灶,表明存在场效应 (field effect)(图片)由 Donald Lamm, MD, FACS 提供 [Citation ends]. [Figure caption and citation for the preceding image starts]: 低分级尿路上皮癌种植在尿道前列腺部;图中显示用于切除膀胱肿瘤的环状电极(图片)由 Donald Lamm, MD, FACS 提供 [Citation ends].
[Figure caption and citation for the preceding image starts]: 低分级尿路上皮癌种植在尿道前列腺部;图中显示用于切除膀胱肿瘤的环状电极(图片)由 Donald Lamm, MD, FACS 提供 [Citation ends]. [Figure caption and citation for the preceding image starts]: 低分级肿瘤由小卫星灶(小而均匀的叶状体)包围。处于最突出位置的是广基实体瘤,这是高分级肿瘤的典型外观。低分级和高分级肿瘤经常存在于同一例患者中(图片)由 Donald Lamm, MD, FACS 提供 [Citation ends].
[Figure caption and citation for the preceding image starts]: 低分级肿瘤由小卫星灶(小而均匀的叶状体)包围。处于最突出位置的是广基实体瘤,这是高分级肿瘤的典型外观。低分级和高分级肿瘤经常存在于同一例患者中(图片)由 Donald Lamm, MD, FACS 提供 [Citation ends].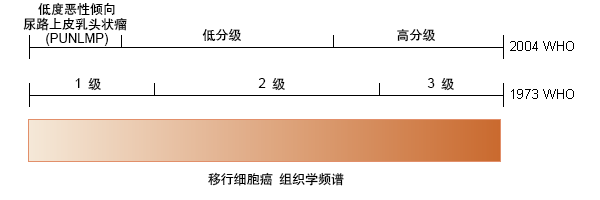 [Figure caption and citation for the preceding image starts]: 1973 年和 2004 年 WHO 分级系统比较。PUNLMP,低恶性倾向尿路上皮乳头状瘤;TCC,移行细胞癌摘自 Eur Urol. 2007;57:889-897;获准使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: 1973 年和 2004 年 WHO 分级系统比较。PUNLMP,低恶性倾向尿路上皮乳头状瘤;TCC,移行细胞癌摘自 Eur Urol. 2007;57:889-897;获准使用 [Citation ends].
欧洲癌症研究和治疗组织 (European Organisation for Research and Treatment of Cancer, EORTC) 评分系统[12]
约 75%-80% 的膀胱癌表现为非肌层浸润性疾病,而其余膀胱癌则表现为肌层浸润性疾病。[13] 在非肌层浸润性膀胱癌 (non-muscle-invasive bladder cancer, NMIBC) 中,约 70% 为 Ta 期病变、20%为 T1 期病变,10% 为原位癌(Tis 病变)。[14]
NMIBC 代表肿瘤结局截然不同的一组异质性肿瘤。例如,低分级肿瘤有中度复发率,但进展风险低。与此不同,高分级肿瘤与显著的复发率、进展和死亡率相关。
膀胱肿瘤中的这种异质性使得比较不同治疗模式的效力以及由此确定统一的治疗建议更加困难。因此,为了分类复发和进展风险类似的患者,进行危险分层必不可少,并且有助于确定各类风险患者的适当管理策略。
虽然受限于化疗方法较为陈旧和卡介苗 (BCG) 的临床试验较少,后者可能会大大提高预计风险,但目前认为 EORTC 风险表有利于评估 NMIBC 的进展和/或复发。EORTC 评分系统结合了既往肿瘤复发率、肿瘤数量、肿瘤直径、T 分期和 WHO 等级以及是否存在伴发性原位癌的数据,以评估复发和进展风险。[15] [Figure caption and citation for the preceding image starts]: 低分级非浸润性 (Ta) 乳头状尿路上皮癌;注意邻近卫星灶,表明存在场效应 (field effect)(图片)由 Donald Lamm, MD, FACS 提供 [Citation ends].
[Figure caption and citation for the preceding image starts]: 低分级非浸润性 (Ta) 乳头状尿路上皮癌;注意邻近卫星灶,表明存在场效应 (field effect)(图片)由 Donald Lamm, MD, FACS 提供 [Citation ends].
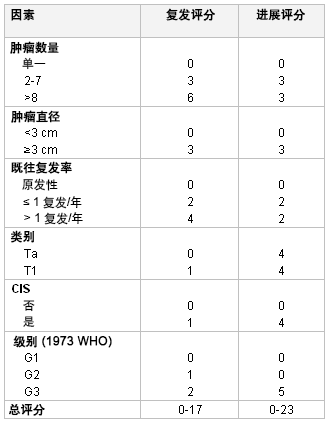 [Figure caption and citation for the preceding image starts]: 欧洲癌症研究和治疗组织 (European Organisation for Research and Treatment of Cancer, EORTC) 评分系统:使用加权以计算复发和进展评分。CIS,原位癌源自 World J Urol. 2007;25:285-295;获准使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: 欧洲癌症研究和治疗组织 (European Organisation for Research and Treatment of Cancer, EORTC) 评分系统:使用加权以计算复发和进展评分。CIS,原位癌源自 World J Urol. 2007;25:285-295;获准使用 [Citation ends].
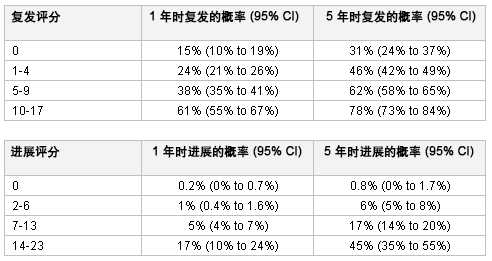 [Figure caption and citation for the preceding image starts]: 欧洲癌症研究和治疗组织 (EORTC) 风险表:根据评分评估复发和进展的可能性源自 World J Urol. 2007;25:285-295;获准使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: 欧洲癌症研究和治疗组织 (EORTC) 风险表:根据评分评估复发和进展的可能性源自 World J Urol. 2007;25:285-295;获准使用 [Citation ends].
EORTC 风险表的主要局限性是,风险分组依据的大部分患者均接受较陈旧的膀胱灌注化疗方案进行治疗。很少使用卡介苗 (BCG)。增加 BCG 的使用后,数据显示,该表过高估计了复发和进展风险。[16]
可下载根据这些量表编制的网页版 EORTC 风险计算器,并根据进展和/或复发风险确定最合适的治疗策略。European Organisation for Research and Treatment of Cancer (EORTC) scoring system and risk tables for stage Ta T1 bladder cancer
使用此内容应接受我们的免责声明。
